VMP 20.12.2018

Иммунология: структура и функции иммунной системы: учебное пособие / Р.М. Хаитов. – 2013. – 280 с.
Глава 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Иммунитет – особое биологическое свойство многоклеточных организмов, направленное на защиту от генетически чужеродных факторов: микроорганизмов (бактерий, вирусов, простейших, грибов), инородных молекул и др. Иммунитет также обеспечивает невосприимчивость организма к инфекции при повторной встрече с патогеном. В медицинском смысле этот термин употребляли ещё до нашей эры в значениях: неприкосновенный, чистый, не затронутый заболеванием, невредимый, находящийся под хорошей защитой, устойчивый к заразной болезни.
Совокупность органных, тканевых, клеточных и молекулярных компонентов, функцией которых является осуществление иммунной защиты, называется иммунной системой. Иммунология – наука о строении и функциях иммунной системы как в норме, так и при различных патологических состояниях, в том числе и при нарушениях самой иммунной системы – иммунопатологиях.
Иммунную защиту обеспечивают два механизма: врождённый и адаптивный.
Врождённый иммунитет является присущей каждому организму с рождения, генетически закреплённой способностью противостоять инфекции. Это передовая линия обороны организма против патогенов, пытающихся проникнуть или уже проникших в покровные ткани или внутреннюю среду. Врождённый иммунитет срабатывает мгновенно или в течение первых нескольких часов после контакта с патогеном (возбудители, выделяемые ими токсины и другие чужеродные молекулы). Он включает четыре основных уровня защиты: анатомический, физиологический, фагоцитарный и воспалительный – покровные ткани, фагоциты, микробоцидные гуморальные вещества (протеазы, сильные окислители и свободные радикалы, продуцируемые фагоцитами, эндогенные противомикробные пептиды и др.), сосудистые реакции. Первичные рецепторы врождённого иммунитета – это молекулы многоклеточных, позволяющие «считывать» эволюционную память – информацию о том, чем отличаются микроорганизмы от собственных клеток.
Эти рецепторы способны распознавать консервативные молекулярные структуры – РАМР (Pathogen-Associated Molecular Patterns), характерные для групп сходных микроорганизмов. В настоящее время постоянно открывают новые патогенраспознающие рецепторы врождённого иммунитета. К ним относят мембраносвязанные паттернраспознающие рецепторы (Pattern Recognition Receptors, PRR), а также растворимые рецепторы – ряд белков сыворотки крови: C-реактивный белок (СРБ), маннозосвязывающий лектин (MBL – Mannose-Binding Lectin), компоненты комплемента.
Собственные возможности клеток врождённого иммунитета санировать организм от проникшего патогена часто недостаточны. Множество патогенов приспособилось выживать в присутствии факторов врождённой резистентности к инфекциям. Именно поэтому в процессе эволюции, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный иммунитет – специфический. Материальные носители адаптивного иммунитета – лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток – способность распознавать почти неограниченное (1018) разнообразие молекулярных объектов – антигенов. Лимфоциты характеризуются экспрессией Т-клеточных (TCR) или В-клеточных (BCR) рецепторов, распознающих только одну антигенную детерминанту либо небольшое число структурно очень близких детерминант, и поэтому, в отличие от PRR, обладающих высокой специфичностью (рис. 1-1).
Адаптивный (приобретённый) иммунитет формируется в течение жизни индивидуума. Активно приобретённый иммунитет – состояние невосприимчивости к инфекции после перенесённого инфекционного заболевания или после вакцинации (сам организм вырабатывает соответствующие антитела). Пассивно приобретённый иммунитет – состояние невосприимчивости к инфекции в результате поступления в организм уже готовых антител от матери или в результате инъекции (сам организм эти антитела не вырабатывает).
ИММУННЫЙ ОТВЕТ
Врождённая и адаптивная системы защиты организма включают клеточный и гуморальный компоненты и активно взаимодействуют друг с другом в процессе иммунного ответа. Иммунный ответ – многоэтапный процесс, заключающийся в распознавании и деструкции патогена и повреждённых им тканей. В его основе лежит уникальное свойство иммун-
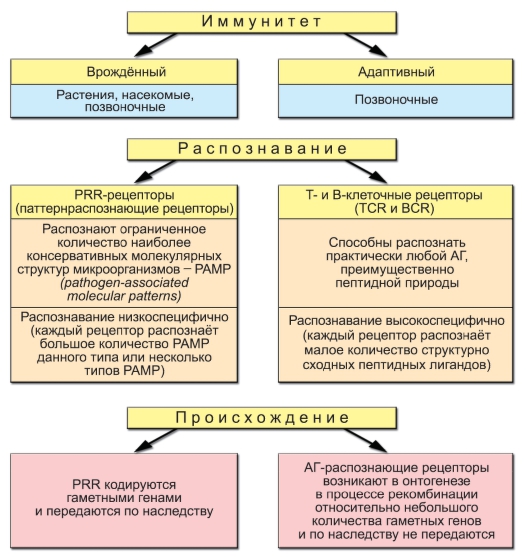
Рис. 1-1. Сравнение врождённого и адаптивного иммунитета
ной системы отличать «свое» («sef») от «чужого» («nonself») и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно – иммунные реакции. Распознавание множества чужеродных антигенов происходит благодаря наличию в организме огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов главного комплекса гистосовместимости (MHC) классов I и II. Нейтрализацию «чужого» осуществляют цирку-
лирующие в жидкостях организма антитела (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет).
Таким образом, основными характеристиками адаптивного иммунного ответа являются умение различать собственные антигены от чужеродных, специфичность и иммунная память.
• Различение «своего» и «чужого» выражается в дифференциации компонентов собственных тканей организма и чужеродных молекул. Специфическую неотвечаемость организма на собственные антигены обозначают как иммунную толерантность. Если же организм воспринимает собственные компоненты как чужеродные, развивается аутоиммунный ответ.
• Специфичность иммунного ответа проявляется в том, что иммунитет, сформировавшийся в результате контакта с определённым антигеном, будет обеспечивать защиту только против этого антигена.
• Иммунная память формируется в результате адаптивного иммунного ответа против конкретного возбудителя и сохраняется, как правило, в течение всей последующей жизни организма, защищая его от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к «запоминанию» антигенных детерминант патогена за счёт образования клеток иммунной памяти. Наличие иммунной памяти обусловливает развитие ускоренного и усиленного ответа (вторичный иммунный ответ) при повторном контакте с антигеном. Формирование иммунной памяти является основной целью вакцинации, т.е. процесса естественного или искусственного формирования иммунной защиты против определённой инфекции.
Схема развития иммунного ответа представлена на рис. 1-2. Содержание отдельных этапов иммунного ответа раскрыто ниже.
• Воспаление: участвуют клетки, поглощающие антигены (фагоциты, антигенпрезентирующие клетки) – в частности, дендритные клетки (ДК), макрофаги, эндотелиальные и другие клетки. Выделяются провоспалительные цитокины и хемокины.
• Переработка антигена (процессинг). После поглощения антигена антигенпрезентирующей клеткой (АПК) происходит его процессинг (расщепление и встраивание в молекулы MHC) и презентация на поверхности клетки. Это необходимо для распознавания антигена Т-лимфоцитами.
• Распознавание антигена происходит в периферических лимфоидных органах. Начало специфического иммунного ответа – про-
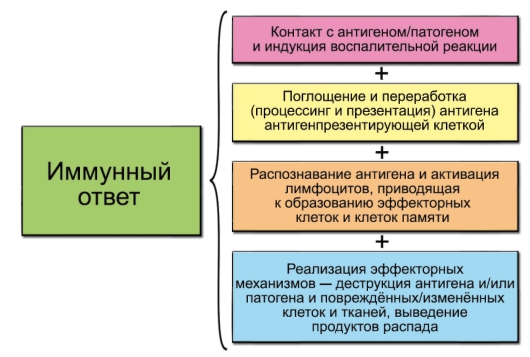
Рис. 1-2. Основные этапы иммунного ответа
лиферация и дифференцировка эффекторных и регуляторных лимфоцитов.
• Деструкция антигена и повреждённых патогеном тканей. При этом одни лимфоциты (помощники – хелперы) «нанимают» для выполнения эффекторных функций другие лимфоциты (эффекторные) и/или воспалительные лейкоциты (нейтрофилы, моноциты, базофилы, эозинофилы), тучные клетки, а также гуморальные литические системы типа комплемента.
• Выведение продуктов распада происходит с участием известных систем выделения.
КЛЕТКИ ИММУННОЙ СИСТЕМЫ
Клетки иммунной системы условно подразделяют на клетки врождённого и адаптивного иммунитета (рис. 1-3). Главным их различием является специфичность распознавания: низкая у первых и высокая у вторых. Существует и третья группа клеток – промежуточная, несущая черты обеих групп. Наличие этой группы показывает единство происхождения и способов защиты организма от чужеродных веществ антигенной природы.
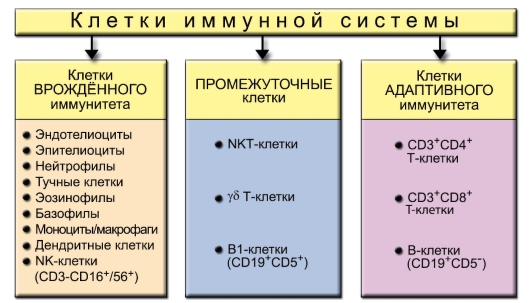
Рис. 1-3. Клетки иммунной системы
В выполнении эффекторных иммунных функций очень важную роль играют АПК, T- и B-лимфоциты и NK-клетки (от англ. Natural Killer – естественный киллер, натуральный киллер).
• Антигенпрезентирующие клетки (АПК). К АПК относят макрофаги, дендритные клетки (включая клетки Лангерганса эпидермиса, М-клетки лимфатических фолликулов пищеварительного тракта и других слизистых оболочек, дендритные эпителиальные клетки тимуса), а также B-лимфоциты. АПК захватывают антиген, обрабатывают его (процессируют) и презентируют антигенные фрагменты на своей поверхности T-лимфоцитам (рис. 1-4).
• T-лимфоциты обусловливают клеточный иммунный ответ, а также помогают отвечать на антиген B-лимфоцитам при гуморальном иммунном ответе. Каждый T-лимфоцит несет на своей поверхности рецептор T-лимфоцитов (TCR – T-Cell Receptor) (см. рис. 5-1, в и рис. 6-1) строго одной специфичности, т.е. взаимодействующий с одним антигеном. T-клетки по экспрессии маркёрных антигенов CD (Cluster Differentiation) подразделяют на CD4+ и CD8+.
– CD4+ Т-лимфоциты (хелперы). Среди T-клеток, экспрессирующих мембранные маркёры CD4, выделяют Т-лимфоциты с эффекторными функциями (Th1, Th2, Th17) и Т-регуляторные клетки (естественные – Treg и индуцированные – Th3, или Tr1).
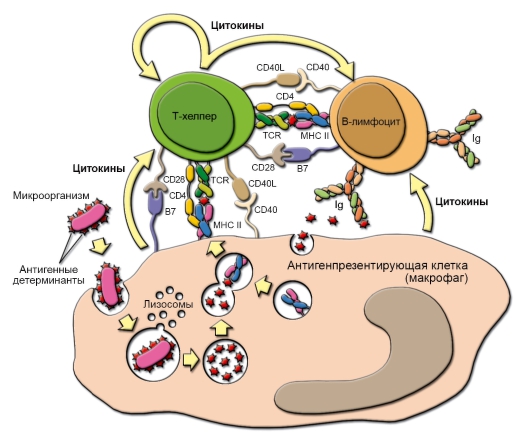
Рис. 1-4. Взаимодействие клеток в ходе гуморального иммунного ответа. Рецептор T-хелпера (TCR) распознаёт антигенную детерминанту (эпитоп), экспрессированную на поверхности антигенпрезентирующей клетки вместе с молекулой главного комплекса гистосовместимости класса II (MHC-II). Во взаимодействии участвует маркёрная молекула T-хелпера – CD4. В результате подобного взаимодействия антигенпрезентирующая клетка секретирует интерлейкин-1 (ИЛ-1), стимулирующий в T-хелпере синтез и секрецию цитокинов, включая ИЛ-2, а также синтез и перенос на плазматическую мембрану T-хелпера рецепторов для ИЛ-2 (ИЛ-2 также стимулирует пролиферацию T-хелперов). Отбор B-лимфоцитов происходит при взаимодействии антигена с вариабельными участками антител (иммуноглобулинов) на поверхности этих клеток (правая часть рисунка). Эпитоп этого антигена в комплексе с молекулой MHC-II распознаёт рецептор T-хелпера, после чего T-лимфоцит секретирует цитокины, стимулирующие пролиферацию B-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие антитела к данному антигену. Также показаны некоторые мембранные белки (CD40/CD40L и CD28/B7), участвующие в проведении костимуляторных сигналов, необходимых для полноценной активации взаимодействующих клеток (они описаны подробнее в главе 7)
◊ T-хелперы при взаимодействии с АПК специфически распознают антигены и начинают вырабатывать определённый набор цитокинов соответственно типу инфекционного агента: Th2 при взаимодействии с B-клетками индуцируют гуморальный иммунный ответ (см. рис. 1-4), а Th1 – при взаимодействии с макрофагами и цитотоксическими Т-лимфоцитами (ЦТЛ) – клеточный иммунный ответ. Th17 продуцируют ИЛ17 – мощный индуктор тканевого воспаления, привлекающий и активирующий гранулоциты и макрофаги.
◊ Регуляторные T-клетки (Т-регуляторы) контролируют интенсивность иммунного ответа, подавляя активность других субпопуляций Т-лимфоцитов.
– CD8+ Т-лимфоциты. Субпопуляция T-клеток, экспрессирующих мембранные молекулы CD8. Эти клетки выступают в роли ЦТЛ. Они лизируют клетки-мишени, несущие чужеродные или видоизменённые собственные антигены – аутоантигены: например, клетки опухоли, трансплантата, инфицированные вирусом клетки, несущие поверхностные вирусные антигены. Эффекторные функции ЦТЛ реализуются через индукцию образования в клетках-мишенях пор (под действием особых белков – перфоринов) и секрецию в поры специализированных сериновых протеаз – гранзимов. Вызванное этим нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки (рис. 1-5). Под влиянием гранзимов индуцируются процессы запрограммированной гибели клетки – апоптоза.
• Т-клетки памяти – долгоживущие рециркулирующие малые лимфоциты, формируемые при первичном иммунном ответе. Они «запоминают» особенности детерминант антигенов и при повторном распознавании того же антигена развивают быстрый и усиленный ответ. Т-клетки памяти отличаются от наивных и эффекторных Т-лимфоцитов высоким уровнем экспрессии мембранных маркёров активации, меньшей потребностью в провоспалительных медиаторах и корецепторных сигналах для развития вторичного иммунного ответа.
• B-лимфоциты отвечают за гуморальный иммунный ответ. На мембране B-лимфоцитов присутствует рецептор для антигена – мономер IgM. Продолжительность жизни большинства B-лимфоцитов (если они не активируются антигеном!) не превышает 10 сут.
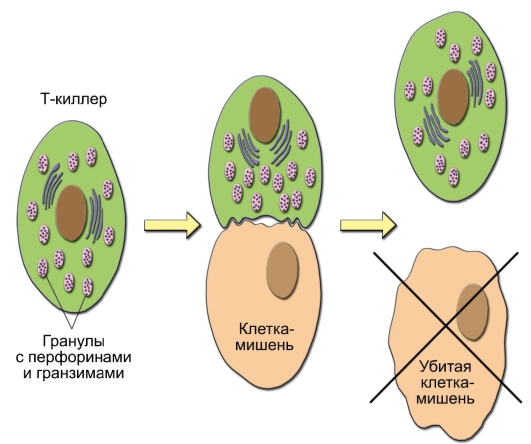
Рис. 1-5. Уничтожение клетки-мишени цитотоксическим T-лимфоцитом (Т-киллером). При сближении цитотоксического T-лимфоцита с клеткоймишенью после специфичного взаимодействия мембранных молекул клетокпартнёров T-лимфоцит убивает клетку-мишень
– Эффекторные B-лимфоциты. Активированные B-лимфоциты размножаются и дифференцируются в плазматические клетки (см. рис. 5-9), вырабатывающие антитела (иммуноглобулины, специфичные к конкретному антигену). При этом плазматические клетки теряют экспрессию специфических рецепторов для антигена.
– B-лимфоциты иммунной памяти – долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об антигене, с которым когда-то контактировали, за счёт продолжающейся экспрессии рецептора для антигена. Клетки памяти активируются
при повторном распознавании того же антигена. В этом случае B-лимфоциты памяти, при обязательном участии T-хелперов и ряда других факторов, превращаются в плазматические клетки, обеспечивая быстрый синтез большого количества специфичных антител, взаимодействующих с чужеродным антигеном, и развитие эффективного иммунного ответа. • NK-клетки (от англ. Natural Killer – естественный киллер) – лимфоциты, лишённые характерных для T- и B-клеток поверхностных CD-маркёров, а также антигенраспознающих рецепторов – TCR (T Cell Receptor) или BCR (B Cell Receptor). Эти клетки играют важную роль в механизмах врождённого иммунитета (см. главу 3), уничтожают трансформированные, инфицированные вирусами и чужеродные клетки.
Глава 2. КОМПОНЕНТЫ ИММУННОЙ СИСТЕМЫ
Иммунная система состоит из различных компонентов – органов, тканей и клеток, отнесённых к этой системе по функциональному критерию (выполнение иммунной защиты организма) и анатомофизиологическому принципу организации (органно-циркуляторный принцип). В иммунной системе выделяют: первичные органы (костный мозг и тимус), вторичные органы (селезёнка, лимфатические узлы, пейеровы бляшки и др.), а также диффузно расположенную лимфоидную ткань – отдельные лимфоидные фолликулы и их скопления. Особо выделяют лимфоидную ткань, ассоциированную со слизистыми оболочками (Mucosa-Associated Lymphoid Tussue – MALT).
Лимфоидная система – совокупность лимфоидных клеток и органов. Часто лимфоидную систему упоминают как анатомический эквивалент и синоним иммунной системы, однако это не вполне верно. Лимфоидная система является лишь частью иммунной системы: по лимфатическим сосудам клетки иммунной системы мигрируют к лимфоидным органам – месту индукции и формирования иммунного ответа. Кроме того, лимфоидную систему не следует путать с лимфатической – системой лимфатических сосудов, по которым происходит циркуляция лимфы в организме. Лимфоидная система тесно связана с кровеносной и эндокринной системами, а также с покровными тканями – слизистыми оболочками и кожей. Названные системы – основные партнёры, на которые в своей работе опирается иммунная система.
Органно-циркуляторный принцип организации иммунной системы. В организме взрослого здорового человека содержится около 1013 лимфоцитов, т.е. примерно каждая десятая клетка тела – лимфоцит. Анатомо-физиологически иммунная система организована по органноциркуляторному принципу. Это означает, что лимфоциты не являются строго резидентными клетками, а интенсивно рециркулируют между лимфоидными органами и нелимфоидными тканями через лимфатические сосуды и кровь. Так, через каждый лимфатический узел за 1 ч проходит ≈109 лимфоцитов. Миграцию лимфоцитов обусловливают
специфические взаимодействия конкретных молекул на мембранах лимфоцитов и клеток эндотелия стенки сосудов [такие молекулы называют адгезинами, селектинами, интегринами, хоминг-рецепторами (от англ. home – дом, место прописки лимфоцита)]. В результате каждый орган обладает характерным набором популяций лимфоцитов и их клеток-партнёров по иммунному ответу.
Состав иммунной системы. По типу организации выделяют различные органы и ткани иммунной системы (рис. 2-1).
• Кроветворный костный мозг – место локализации стволовых кроветворных клеток (СКК).
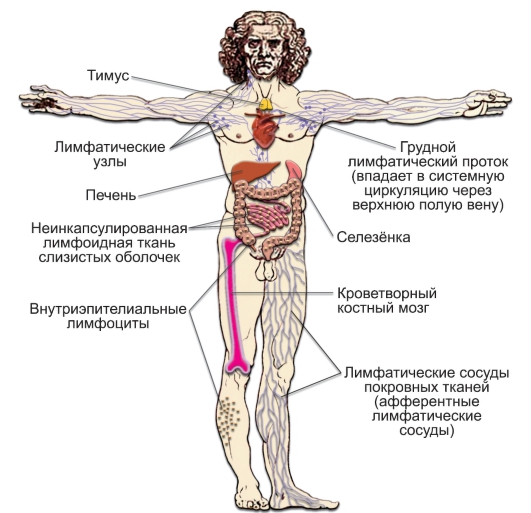
Рис. 2-1. Компоненты иммунной системы
• Инкапсулированные органы: тимус, селезёнка, лимфатические узлы.
• Неинкапсулированная лимфоидная ткань.
– Лимфоидная ткань слизистых оболочек (MALT – MucosalAssociated Lymphoid Tissue). Независимо от локализации содержит внутриэпителиальные лимфоциты слизистой оболочки, а также специализированные образования:
◊ лимфоидная ткань, ассоциированная с пищеварительным трактом (GALT – Gut-Associated Lymphoid Tissue). В ней выделяют миндалины, аппендикс, пейеровы бляшки, lamina propria («собственная пластинка») кишечника, отдельные лимфоидные фолликулы и их группы;
◊ лимфоидная ткань, ассоциированная с бронхами и бронхиолами (BALT – Bronchus-Associated Lymphoid Tissue);
◊лимфоидная ткань, ассоциированная с женскими половыми путями (VALT – Vulvovaginal-Associated Lymphoid Tissue);
◊лимфоидная ткань, ассоциированная с носоглоткой (NALT – Nose-Associated Lymphoid Tissue).
– Особое место в иммунной системе занимает печень. В ней присутствуют субпопуляции лимфоцитов и других клеток иммунной системы, «обслуживающие» в качестве лимфоидного барьера кровь воротной вены, несущей все всасываемые в кишечнике вещества.
– Лимфоидная подсистема кожи – лимфоидная ткань, ассоциированная с кожей (SALT – Skin-Associated Lymphoid Tissue) – диссеминированные внутриэпителиальные лимфоциты и региональные лимфатические узлы и сосуды лимфодренажа.
• Периферическая кровь – транспортно-коммуникационный компонент иммунной системы.
Центральные и периферические органы иммунной системы
• Центральные органы. Кроветворный костный мозг и тимус – центральные органы иммунной системы, именно в них начинается миелопоэз и лимфопоэз – дифференцировка моноцитов и лимфоцитов от СКК до зрелой клетки.
– До рождения плода развитие В-лимфоцитов происходит в фетальной печени. После рождения эта функция передаётся костному мозгу.
– В костном мозге проходят полные «курсы» эритропоэза (образование эритроцитов), миелопоэза (образование нейтрофилов,
моноцитов, эозинофилов, базофилов), мегакариоцитопоэза (формирование тромбоцитов), а также проходит дифференцировка ДК, NK-клеток и В-лимфоцитов. – Предшественники T-лимфоцитов для прохождения лимфопоэза мигрируют из костного мозга в тимус и слизистую оболочку пищеварительного тракта (внетимическое развитие).
• Периферические органы. В периферических лимфоидных органах (селезёнка, лимфатические узлы, неинкапсулированная лимфоидная ткань) зрелые наивные лимфоциты контактируют с антигеном и АПК. Если антигенраспознающий рецептор лимфоцита связывает комплементарный антиген в периферическом лимфоидном органе, то лимфоцит вступает на путь дальнейшей дифференцировки в режиме иммунного ответа, т.е. начинает пролиферировать и продуцировать эффекторные молекулы – цитокины, перфорин, гранзимы и др. Такую додифференцировку лимфоцитов на периферии называют иммуногенезом. В результате иммуногенеза формируются клоны эффекторных лимфоцитов, распознающих антиген и организующих деструкцию как его самого, так и периферических тканей организма, где этот антиген присутствует.
Клетки иммунной системы. В состав иммунной системы входят клетки различного происхождения – мезенхимного, экто- и энтодермального.
• Клетки мезенхимного генеза. К ним относят клетки, дифференцировавшиеся из предшественников лимфо/гематопоэза. Разновидности лимфоцитов – T, B и NK, которые в процессе иммунного ответа кооперируются с различными лейкоцитами – моноцитами/ макрофагами, нейтрофилами, эозинофилами, базофилами, а также ДК, тучными клетками и эндотелиоцитами сосудов. Даже эритроциты вносят свой вклад в реализацию иммунного ответа: транспортируют иммунные комплексы «антиген-антитело-комплемент» в печень и селёзенку для фагоцитоза и разрушения.
• Эпителий. В состав некоторых лимфоидных органов (тимус, некоторые неинкапсулированные лимфоидные ткани) входят эпителиальные клетки эктодермального и энтодермального происхождения.
Гуморальные факторы. Помимо клеток, «иммунная материя» представлена растворимыми молекулами – гуморальными факторами. Это продукты B-лимфоцитов – антитела (они же иммуноглобулины) и растворимые медиаторы межклеточных взаимодействий – цитокины.
ТИМУС
В тимусе (thymus) проходит лимфопоэз значительной части T-лимфоцитов («Т» происходит от слова «Thymus»). Тимус состоит из 2 долей, каждая из которых окружена капсулой из соединительной ткани. Перегородки, идущие от капсулы, разделяют тимус на дольки. В каждой дольке тимуса (рис. 2-2) выделяют 2 зоны: по периферии – корковая (cortex), в центре – мозговая (medulla). Объём органа заполнен эпителиальным каркасом (эпителий), в котором располагаются тимоциты (незрелые Т-лимфоциты тимуса), ДК и макрофаги. ДК расположены преимущественно в зоне, переходной между корковой и мозговой. Макрофаги присутствуют во всех зонах.
• Эпителиальные клетки своими отростками обхватывают лимфоциты тимуса (тимоциты), поэтому их называют «nurse cells» (клетки-«сиделки» или клетки-«няньки»). Эти клетки не только поддерживают развивающиеся тимоциты, но также продуцируют
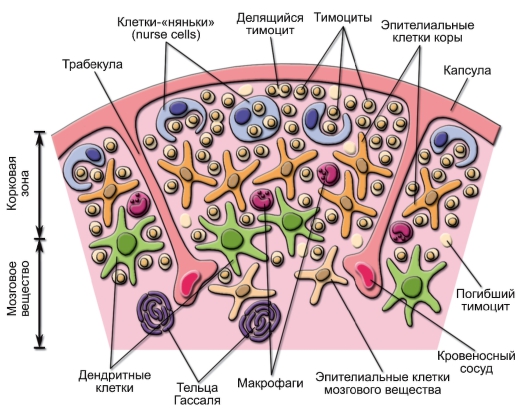
Рис. 2-2. Строение дольки тимуса
цитокины ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-7, LIF, GM-CSF и экспрессируют молекулы адгезии LFA-3 и ICAM-1, комплементарные молекулам адгезии на поверхности тимоцитов (CD2 и LFA-1). В мозговой зоне долек расположены плотные образования из скрученных эпителиальных клеток – тельца Гассаля (тельца тимуса) – места компактного скопления дегенерирующих эпителиальных клеток.
• Тимоциты дифференцируются из костномозговых СКК. Из тимоцитов в процессе дифференцировки образуются Т-лимфоциты, способные распознавать антигены в комплексе с MHC. Однако большинство Т-лимфоцитов либо не сможет обладать этим свойством, либо будет распознавать аутоантигены. Для предотвращения выхода таких клеток на периферию в тимусе инициируется их элиминация путем индукции апоптоза. Таким образом, в норме в циркуляцию из тимуса выходят только клетки, способные распознавать антигены в комплексе со «своими» MHC, но при этом не индуцирующие развитие аутоиммунных реакций.
• Гематотимический барьер. Тимус сильно васкуляризован. Стенки капилляров и венул образуют гематотимический барьер на входе в тимус и, возможно, на выходе из него. Зрелые лимфоциты выходят из тимуса либо свободно, так как каждая долька имеет эфферентный лимфатический сосуд, выносящий лимфу в лимфатические узлы средостения, либо путём экстравазации через стенку посткапиллярных венул с высоким эндотелием в корково-мозговой области и/или через стенку обычных кровеносных капилляров.
• Возрастные изменения. К моменту рождения тимус полностью сформирован. Он густо заселён тимоцитами в течение всего детства и до момента полового созревания. После пубертата тимус начинает уменьшаться в размерах. Тимэктомия у взрослых не приводит к серьёзным нарушениям иммунитета, поскольку в детстве и подростковом возрасте создаётся необходимый и достаточный пул периферических T-лимфоцитов на всю оставшуюся жизнь.
ЛИМФАТИЧЕСКИЕ УЗЛЫ
Лимфатические узлы (рис. 2-3) – множественные, симметрично расположенные, инкапсулированные периферические лимфоидные органы бобовидной формы, размером от 0,5 до 1,5 см в длину (при отсутствии воспаления). Лимфатические узлы через афферентные (приносящие) лимфатические сосуды (их несколько на каждый узел) дренируют тка-
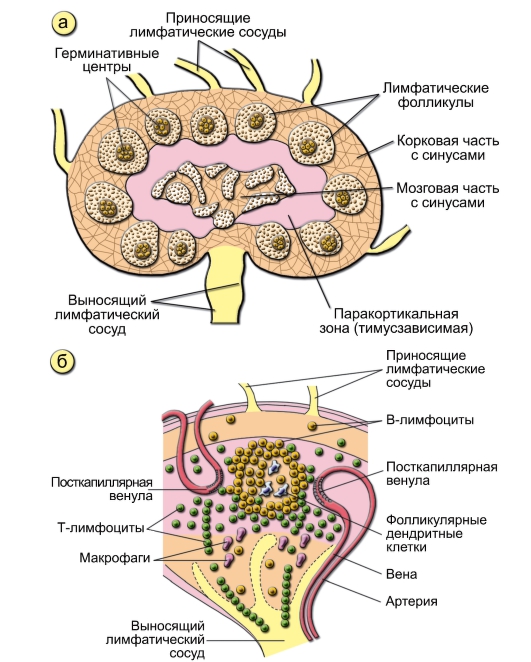
Рис. 2-3. Строение лимфатического узла мыши: а – корковая и мозговая части. В корковой части расположены лимфатические фолликулы, от которых в мозговую часть отходят мозговые тяжи; б – распределение T- и B-лимфоцитов. Тимусзависимая зона выделена розовым цветом, тимуснезависимая зона – жёлтым. T-лимфоциты поступают в паренхиму узла из посткапиллярных венул и вступают в контакт с фолликулярными дендритными клетками и B-лимфоцитами
невую жидкость. Таким образом, лимфатические узлы – «таможня» для всех веществ, в том числе для антигенов. Из анатомических ворот узла вместе с артерией и веной выходит единственный эфферентный (выносящий) сосуд. В итоге лимфа попадает в грудной лимфатический проток. Паренхима лимфатического узла состоит из T-клеточной, B-клеточной зон и мозговых тяжей.
• B-клеточная зона. Корковое вещество разделено соединительнотканными трабекулами на радиальные секторы и содержит лимфоидные фолликулы, это B-лимфоцитарная зона. Строма фолликулов содержит фолликулярные дендритные клетки (ФДК), формирующие особое микроокружение, в котором происходит уникальный для B-лимфоцитов процесс соматического гипермутагенеза вариабельных сегментов генов иммуноглобулинов и отбор наиболее аффинных вариантов антител («созревание аффинности антител»). Лимфоидные фолликулы проходят 3 стадии развития. Первичный фолликул – мелкий фолликул, содержащий наивные B-лимфоциты. После того как B-лимфоциты вступают в иммуногенез, в лимфоидном фолликуле появляется герминативный (зародышевый) центр, содержащий интенсивно пролиферирующие B-клетки (это происходит примерно через 4-5 дней после активной иммунизации). Это вторичный фолликул. По завершении иммуногенеза лимфоидный фолликул существенно уменьшается в размере.
• T-клеточная зона. В паракортикальной (T-зависимой) зоне лимфатического узла расположены T-лимфоциты и интердигитальные ДК (они отличаются от ФДК) костномозгового происхождения, которые презентируют антигены T-лимфоцитам. Через стенку посткапиллярных венул с высоким эндотелием происходит миграция лимфоцитов из крови в лимфатический узел.
• Мозговые тяжи. Под паракортикальной зоной расположены содержащие макрофаги мозговые тяжи. При активном иммунном ответе в этих тяжах можно видеть множество зрелых B-лимфоцитов – плазматические клетки. Тяжи впадают в синус мозгового вещества, из которого выходит эфферентный лимфатический сосуд.
СЕЛЕЗЁНКА
Селезёнка – относительно большой непарный орган массой около 150 г. Лимфоидная ткань селезёнки – белая пульпа. Селезёнка – лимфоцитарная «таможня» для антигенов, попавших в кровь. Лимфоциты
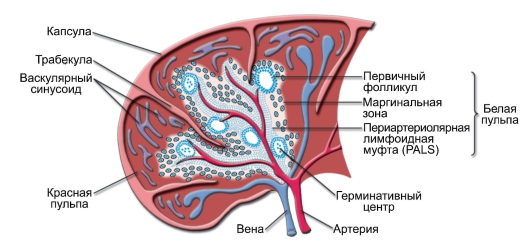
Рис. 2-4. Селезёнка человека. Тимусзависимая и тимуснезависимая зоны селезёнки. Скопление T-лимфоцитов (зелёные клетки) вокруг артерий, вышедших из трабекул, образует тимусзависимую зону. Лимфатический фолликул и окружающая его лимфоидная ткань белой пульпы формируют тимуснезависимую зону. Так же как и в фолликулах лимфатических узлов, здесь присутствуют B-лимфоциты (жёлтые клетки) и фолликулярные дендритные клетки. Вторичный фолликул содержит герминативный центр с быстроделящимися В-лимфоцитами, окружёнными кольцом малых покоящихся лимфоцитов (мантией)
селезёнки накапливаются вокруг артериол в виде так называемых периартериолярных муфт (рис. 2-4).
T-зависимая зона муфты непосредственно окружает артериолу. B-клеточные фолликулы расположены ближе к краю муфты. Артериолы селезёнки впадают в синусоиды (это уже красная пульпа). Синусоиды заканчиваются венулами, собирающимися в селезёночную вену, несущую кровь в воротную вену печени. Красную и белую пульпу разделяет диффузная маргинальная зона, населенная особой популяцией В-лимфоцитов (В-клетки маргинальной зоны) и особыми макрофагами. Клетки маргинальной зоны являются важным связующим звеном между врождённым и приобретённым иммунитетом. Здесь происходит самый первый контакт организованной лимфоидной ткани с возможными патогенами, циркулирующими в крови.
ПЕЧЕНЬ
Печень выполняет важные иммунные функции, что вытекает из следующих фактов:
• печень – мощный орган лимфопоэза в эмбриональном периоде;
• аллогенные трансплантаты печени отторгаются менее интенсивно, чем другие органы;
• толерантность к вводимым перорально антигенам можно индуцировать только при нормальном физиологическом кровоснабжении печени и не удаётся индуцировать после операции по созданию портокавальных анастомозов;
• печень синтезирует белки острой фазы (СРБ, MBL и др.), а также белки системы комплемента;
• в печени содержатся разные субпопуляции лимфоцитов, в том числе уникальные лимфоциты, сочетающие признаки T- и NK-клеток (NKT-клетки).
Клеточный состав печени
Гепатоциты формируют паренхиму печени и содержат очень мало молекул MHC-I. Молекулы MHC-II гепатоциты в норме почти не несут, однако их экспрессия может возрастать при заболеваниях печени.
Клетки Купфера – макрофаги печени. Они составляют около 15% от общего числа клеток печени и 80% всех макрофагов организма. Плотность макрофагов выше в перипортальных областях.
Эндотелий синусоидов печени не имеет базальной мембраны – тонкой внеклеточной структуры, состоящей из разных типов коллагенов и других белков. Эндотелиальные клетки формируют монослой с просветами, через которые лимфоциты могут непосредственно контактировать с гепатоцитами. Кроме того, эндотелиальные клетки экпрессируют различные рецепторы-«мусорщики» (scavenger-рецепторы).
Лимфоидная система печени, кроме лимфоцитов, содержит анатомический отдел циркуляции лимфы – пространства Диссе. Эти пространства с одной стороны непосредственно контактируют с кровью синусоидов печени, а с другой – с гепатоцитами. Лимфоток в печени значителен – не менее 15-20% всего лимфотока организма.
Звёздчатые клетки (клетки Ито) расположены в пространствах Диссе. Они содержат жировые вакуоли с витамином А, а также характерные для гладкомышечных клеток α-актин и десмин. Звёздчатые клетки могут трансформироваться в миофибробласты.
ЛИМФОИДНАЯ ТКАНЬ СЛИЗИСТЫХ ОБОЛОЧЕК И КОЖИ
Неинкапсулированная лимфоидная ткань слизистых оболочек представлена глоточным лимфоидным кольцом Пирогова-Вальдейера, пейеровыми бляшками тонкой кишки, лимфоидными фолликулами аппендикса, лимфоидной тканью слизистых оболочек желудка, кишечника, бронхов и бронхиол, органов мочеполовой системы и других слизистых оболочек.
Пейеровы бляшки (рис. 2-5) – групповые лимфатические фолликулы, расположенные в lamina propria тонкой кишки. Фолликулы, точнее T-клетки фолликулов, примыкают к кишечному эпителию под так называемыми M-клетками («М» от Membranous, эти клетки не имеют микроворсинок), являющимися «входными воротами» пейеровой бляшки. Основная масса лимфоцитов расположена в B-клеточных фолликулах с зародышевыми центрами. T-клеточные зоны окружают фолликул ближе к эпителию. B-лимфоциты составляют 50-70%, T-лимфоциты – 10-30% всех клеток пейеровой бляшки. Основная функция пейеровых бляшек – поддержание иммуногенеза B-лимфоцитов и их дифференци-
Глава 3. МЕХАНИЗМЫ ВРОЖДЁННОГО ИММУНИТЕТА
Врождённый иммунитет – наиболее ранний защитный механизм как в эволюционном плане (он существует практически у всех многоклеточных), так и по времени ответа, развивающегося в первые часы и дни после проникновения чужеродного материала во внутреннюю среду, т.е. задолго до развития адаптивной иммунной реакции. Значительную часть патогенов инактивируют именно врождённые механизмы иммунитета, не доводя процесс до развития иммунного ответа с участием лимфоцитов. И только если механизмы врождённого иммунитета не справляются с проникающими в организм патогенами, в «игру» включаются лимфоциты. При этом адаптивный иммунный ответ невозможен без вовлечения механизмов врождённого иммунитета. Кроме того, врождённый иммунитет играет главную роль в удалении апоптотических и некротических клеток и реконструировании повреждённых органов. В механизмах врождённой защиты организма важнейшую роль играют первичные рецепторы для патогенов, система комплемента, фагоцитоз, эндогенные пептиды-антибиотики и факторы защиты от вирусов – интерфероны. Функции врождённого иммунитета схематично представлены на рис. 3-1.
РЕЦЕПТОРЫ РАСПОЗНАВАНИЯ «ЧУЖОГО»
На поверхности микроорганизмов присутствуют повторяющиеся молекулярные углеводные и липидные структуры, которые в подавляющем большинстве случаев отсутствуют на клетках организма хозяина. Особые рецепторы, распознающие этот «узор» на поверхности патогена, – PRR (Pattern Recognition Receptors – паттернраспознающие рецепторы) – позволяют клеткам врождённого иммунитета обнаруживать микробные клетки. В зависимости от локализации выделяют растворимые и мембранные формы PRR.
• Циркулирующие (растворимые) рецепторы для патогенов – белки сыворотки крови, синтезируемые печенью: липополисахаридсвя-
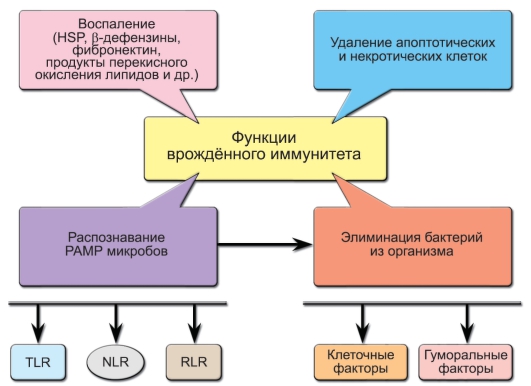
Рис. 3-1. Функции врождённого иммунитета. Обозначения: PAMP (PathogenAssociated Molecular Patterns) – молекулярные структуры микроорганизмов, HSP (Heat Shock Proteins) – белки теплового шока, TLR (Toll-Like Receptors), NLR (NOD-Like Receptors), RLR (RIG-Like Receptors) – клеточные рецепторы
зывающий белок (LBP – Lipopolysaccharide Binding Protein), компонент системы комплемента C1q и белки острой фазы MBL и С-реактивный белок (СРБ). Они непосредственно связывают микробные продукты в жидких средах организма и обеспечивают возможность их поглощения фагоцитами, т.е. являются опсонинами (от греч. opsonein – делающий вкусным). Кроме того, некоторые из них активируют систему комплемента.
– СРБ, связывая фосфорилхолин клеточных стенок ряда бактерий и одноклеточных грибов, опсонизирует их и активирует систему комплемента по классическому пути.
– MBL принадлежит к семейству коллектинов. Имея сродство к остаткам маннозы, экспонированным на поверхности многих микробных клеток, MBL запускает лектиновый путь активации комплемента.
– Белки сурфактанта лёгких – SP-A и SP-D принадлежат к тому же молекулярному семейству коллектинов, что и MBL. Они, вероятно, имеют значение в опсонизации (связывании антител с клеточной стенкой микроорганизма) лёгочного патогена – одноклеточного грибка Pneumocystis carinii.
• Мембранные рецепторы. Эти рецепторы расположены как на наружных, так и на внутренних мембранных структурах клеток.
– TLR (Toll-Like Receptor – Toll-подобный рецептор; т.е. сходный с Toll-рецептором дрозофилы). Одни из них непосредственно связывают продукты патогенов (рецепторы для маннозы макрофагов, TLR дендритных и других клеток), другие работают совместно с иными рецепторами: например, CD14 молекула на макрофагах связывает комплексы бактериального липополисахарида (ЛПС) с LBP, а TLR-4 вступает во взаимодействие с CD14 и передаёт соответствующий сигнал внутрь клетки. Всего у млекопитающих описано 13 различных вариантов TLR (у человека пока только 10).
• Цитоплазматические рецепторы:
– NOD-рецепторы (NOD1 и NOD2) находятся в цитозоле и состоят из трёх доменов: N-концевого CARD-домена, центрального NOD-домена (NOD – Nucleotide Oligomerization Domain – домен олигомеризации нуклеотидов) и C-концевого LRR-домена. Различие между этими рецепторами заключается в количестве CARD-доменов. Рецепторы NOD1 и NOD2 распознают мурамилпептиды – вещества, образующиеся после ферментативного гидролиза пептидогликана, входящего в состав клеточной стенки всех бактерий. NOD1 распознаёт мурамилпептиды с концевой мезодиаминопимелиновой кислотой (meso-DAP), которые образуются только из пептидогликана грамотрицательных бактерий. NOD2 распознаёт мурамилдипептиды (мурамилдипептид и гликозилированный мурамилдипептид) с концевым D-изоглутамином или D-глутаминовой кислотой, являющиеся результатом гидролиза пептидогликана как грамположительных, так и грамотрицательных бактерий. Кроме того, NOD2 имеет сродство к мурамилпептидам с концевым L-лизином, которые есть только у грамположительных бактерий.
– RIG-подобные рецепторы (RLR, RIG-Like Receptors): RIG-I (Retinoic acid-Inducible Gene I), MDA5 (Melanoma Differentiation-associated Antigen 5) и LGP2 (Laboratory of Genetics and Physiology 2).
Все три рецептора, кодируемые этими генами, имеют сходную химическую структуру и локализуются в цитозоле. Рецепторы RIG-I и MDA5 распознают вирусную РНК. Роль белка LGP2 пока неясна; возможно, он выполняет роль хеликазы, связываясь с двуцепочечной вирусной РНК, модифицирует её, что облегчает последующее распознавание с помощью RIG-I. RIG-I распознаёт односпиральную РНК с 5-трифосфатом, а также относительно короткие (<2000 пар оснований) двуспиральные РНК. MDA5 различает длинные (>2000 пар оснований) двуспиральные РНК. Таких структур в цитоплазме эукариотической клетки нет. Вклад RIG-I и MDA5 в распознавание конкретных вирусов зависит от того, образуют ли данные микроорганизмы соответствующие формы РНК.
ПРОВЕДЕНИЕ СИГНАЛОВ С TOLL-ПОДОБНЫХ РЕЦЕПТОРОВ
Все TLR используют одинаковую принципиальную схему передачи активационного сигнала в ядро (рис. 3-2). После связывания с лигандом рецептор привлекает один или несколько адапторов (MyD88, TIRAP, TRAM, TRIF), которые обеспечивают передачу сигнала с рецептора на каскад серин-треониновых киназ. Последние вызывают активацию факторов транскрипции NF-kB (Nuclear Factor of к-chain B-lymphocytes), AP-1 (Activator Protein 1), IRF3, IRF5 и IRF7 (Interferon Regulatory Factor), которые транслоцируются в ядро и индуцируют экспрессию геновмишеней.
Все адапторы содержат TIR-домен и связываются с TIR-доменами TOLL-подобных рецепторов (Toll/Interleukin-1 Receptor, так же как рецептора для ИЛ-1) путём гомофильного взаимодействия. Все известные TOLL-подобные рецепторы, за исключением TLR3, передают сигнал через адаптор MyD88 (MyD88-зависимый путь). Связывание MyD88 с TLR1/2/6 и TLR4 происходит при помощи дополнительного адаптора TIRAP, который не требуется в случае TLR5, TLR7 и TLR9. В передаче сигнала с TLR3 адаптор MyD88 не участвует; вместо него используется TRIF (MyD88-независимый путь). TLR4 использует как MyD88зависимый, так и MyD88-независимый пути передачи сигнала. Однако связывание TLR4 с TRIF происходит при помощи дополнительного адаптора TRAM.
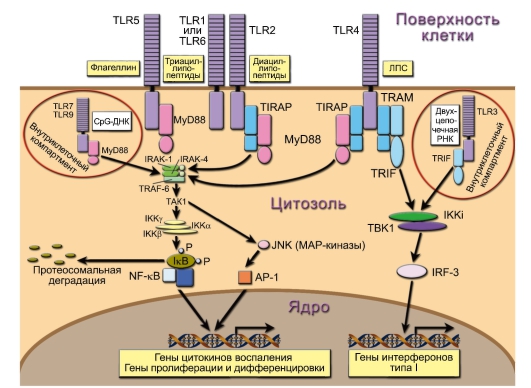
Рис. 3-2. Пути передачи сигналов с Toll-подобных рецепторов (TLR). Указанные на рисунке TLR3, TLR7, TLR9 – внутриклеточные эндосомальные рецепторы; TLR4 и TLR5 – мономерные рецепторы, встроенные в цитоплазматическую мембрану. Трансмембранные димеры: TLR2 с TLR1 или TLR2 с TLR6. Тип распознаваемого димерами лиганда зависит от их состава
MyD88-зависимый путь. Адаптор MyD88 состоит из N-концевого DD-домена (Death Domain – домен смерти) и С-концевого TIRдомена, связанного с рецептором с помощью гомофильного TIR- TIR взаимодействия. MyD88 привлекает киназы IRAK-4 (Interleukin-1 Receptor-Associated Kinase-4) и IRAK-1 через взаимодействие с их аналогичными DD-доменами. Это сопровождается их последовательным фосфорилированием и активацией. После этого IRAK-4 и IRAK-1 отделяются от рецептора и связываются с адаптером TRAF6, который, в свою очередь, привлекает киназу TAK1 и убиквитин-лигазный комплекс (на рис. 3-2 не показан), что приводит к активации TAK1. TAK1 активирует две группы мишеней:
• IκB-киназу (IKK), состоящую из субъединиц IKKα, IKKβ и IKKγ. В результате фактор транскрипции NF-kB освобождается от ингибирующего его белка IκB и транслоцируется в клеточное ядро;
• каскад митоген-активируемых протеинкиназ (MAP-киназ), способствующий активации факторов транскрипции группы AP-1. Состав AP-1 варьирует и зависит от типа активирующего сигнала. Основные его формы – гомодимеры c-Jun или гетеродимеры c-Jun и c-Fos.
Результатом активации обоих каскадов является индукция экспрессии антимикробных факторов и медиаторов воспаления, в том числе фактора некроза опухолей альфа ФНОа (TNFa), который, воздействуя на клетки аутокринно, вызывает экспрессию дополнительных генов. Кроме того, AP-1 инициирует транскрипцию генов, ответственных за пролиферацию, дифференцировку и регуляцию апоптоза.
MyD88-независимый путь. Передача сигнала происходит через адаптер TRIF или TRIF:TRAM и приводит к активации киназы TBK1, которая, в свою очередь, активирует фактор транскрипции IRF3. Последний индуцирует экспрессию интерферонов I типа, которые, как и ФНОа в MyDSS-зависимом пути, воздействуют на клетки аутокринно и активируют экспрессию дополнительных генов (interferon response genes). Активация различных сигнальных путей при стимуляции TLR, вероятно, обеспечивает направленность врождённой иммунной системы на борьбу с тем или иным типом инфекции.
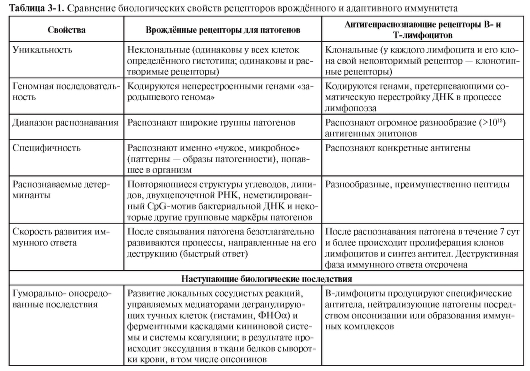
Сравнительная характеристика врождённых и адаптивных механизмов резистентности приведена в табл. 3-1.
Существуют субпопуляции лимфоцитов со свойствами, «промежуточными» между таковыми неклонотипных механизмов врождённого иммунитета и клонотипных лимфоцитов с большим разнообразием рецепторов для антигенов. Они не пролиферируют после связывания антигена (т.е. экспансии клонов не происходит), но в них сразу индуцируется продукция эффекторных молекул. Ответ не слишком специфичен и наступает быстрее, чем «истинно лимфоцитарный», иммунная память не формируется. К таким лимфоцитам можно отнести:
• внутриэпителиальные γδT-лимфоциты с перестроенными генами, кодирующими TCR ограниченного разнообразия, связывают лиганды типа белков теплового шока, нетипичные нуклеотиды, фосфолипиды, MHC-IB;
• B1-лимфоциты брюшной и плевральной полостей имеют перестроенные гены, кодирующие BCR ограниченного разнообразия, которые обладают широкой перекрёстной реактивностью с бактериальными антигенами.

К категории лимфоцитов с «промежуточными» свойствами относят также NK-лимфоциты, или естественные киллеры.
ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ
Особая субпопуляция лимфоцитов – естественные киллеры (NKклетки, натуральные киллеры). Они дифференцируются из общей лимфоидной клетки-предшественника и in vitro способны спонтанно, т.е. без предварительной иммунизации, убивать некоторые опухолевые, а также инфицированные вирусами клетки. NK-клетки являются большими гранулярными лимфоцитами, не экспрессирующими линейных маркёров Т- и В-клеток (CD3, CD19). В циркулирующей крови нормальные киллеры составляют около 15% всех мононуклеарных клеток, а в тканях локализованы в печени (большинство), красной пульпе селезёнки, слизистых оболочках (особенно репродуктивных органов).
Большинство NK-клеток содержит в цитоплазме азурофильные гранулы, где депонированы цитотоксические белки перфорин, гранзимы и гранулизин.
Главными функциями NK-клеток являются распознавание и элиминация клеток, инфицированных микроорганизмами, изменённых в результате злокачественного роста, либо опсонизированных IgGантителами, а также синтез цитокинов ИФНу, ФНОа, GM-CSF, ИЛ-8, ИЛ-5. In vitro при культивировании с ИЛ-2 NK-клетки приобретают высокий уровень цитолитической активности по отношению к широкому спектру мишеней, превращаясь в так называемые LAK-клетки.
Общая характеристика NK-клеток представлена на рис. 3-3. Главные маркёры NK-клеток – молекулы CD56 и CD16 (FcγRIII). CD16 является рецептором для Fc-фрагмента IgG. На NK-клетках имеются рецепторы для ИЛ-15 – ростового фактора NK-клеток, а также для ИЛ-21 – цитокина, усиливающего их активацию и цитолитическую активность. Важную роль играют молекулы адгезии, обеспечивающие контакт с другими клетками и межклеточным матриксом: VLA-5 способствует прилипанию к фибронектину; CD11a/CD18 и CD11b/CD18 обеспечивают присоединение к молекулам эндотелия ICAM-1 и ICAM-2 соответственно; VLA-4 – к молекуле эндотелия VCAM-I; CD31, молекула гомофильного взаимодействия, ответственна за диапедез (выхождение через сосудистую стенку в окружающую ткань) NK-клеток через эпителий; CD2, рецептор для эритроцитов барана, является молекулой адгезии, которая
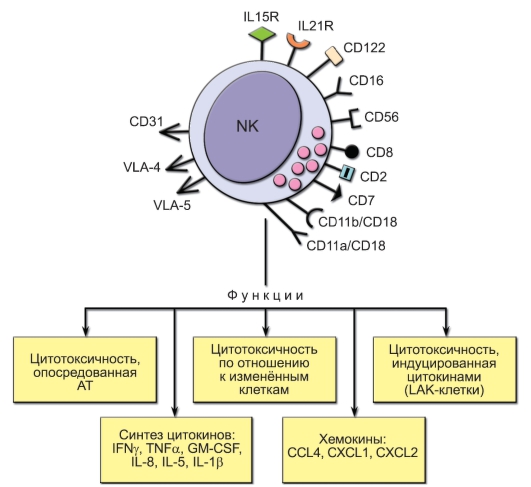
Рис. 3-3. Общая характеристика NK-клеток. IL15R и IL21R – рецепторы для ИЛ-15 и ИЛ-21 соответственно
взаимодействует с LFA-3 (CD58) и инициирует взаимодействие NKклеток с другими лимфоцитами. Помимо CD2, на NK-клетках человека выявляются и некоторые другие маркёры Т-лимфоцитов, в частности CD7 и гомодимер CD8a, но не CD3 и TCR, что отличает их от NKTлимфоцитов.
• По эффекторным функциям NK-клетки близки к T-лимфоцитам: они проявляют цитотоксическую активность в отношении клетокмишеней по тому же перфорин-гранзимовому механизму, что и ЦТЛ (см. рис. 1-4 и рис. 6-4), и продуцируют цитокины – ИФНγ, ФНО, GM-CSF, ИЛ-5, ИЛ-8.
• Отличие естественных киллеров от T-лимфоцитов состоит в том, что у них отсутствует TCR и они распознают комплекс антиген-
MHC иным (не вполне ясным) способом. NK не формируют клетки иммунной памяти.
• На NK-клетках человека есть рецепторы, относящиеся к семейству KIR (Killer-cell Immunoglobulin-like Receptors), способные связывать молекулы MHC-I собственных клеток. Однако эти рецепторы не активируют, а ингибируют киллерную функцию нормальных киллеров. Кроме того, на NK-клетках есть такие иммунорецепторы, как FcyR, и экспрессирована молекула CD8, имеющая сродство к
MHC-I.
• На уровне ДНК гены KIR не перестраиваются, но на уровне первичного транскрипта происходит альтернативный сплайсинг, что обеспечивает определённое разнообразие вариантов этих рецепторов у каждой отдельной NK-клетки. На каждом нормальном киллере экспрессировано более одного варианта KIR.
• H.G. Ljunggren и K. Karre в 1990 г. сформулировали гипотезу «missing self» («отсутствие своего»), согласно которой NK-клетки распознают и убивают клетки своего организма с пониженной или нарушенной экспрессией молекул MHC-I. Поскольку субнормальная экспрессия MHC-I возникает в клетках при патологических процессах, например при вирусной инфекции, опухолевом перерождении, NK-клетки способны убивать инфицированные вирусами или перерождённые клетки собственного организма. Гипотеза «missing self» схематично представлена на рис. 3-4.
СИСТЕМА КОМПЛЕМЕНТА
Комплемент – система сывороточных белков и нескольких белков клеточных мембран, выполняющих 3 важные функции: опсонизацию микроорганизмов для дальнейшего их фагоцитоза, инициацию сосудистых реакций воспаления и перфорацию мембран бактериальных и других клеток. Компоненты комплемента (табл. 3-2, 3-3) обозначают буквами латинского алфавита C, B и D с добавлением арабской цифры (номер компонента) и дополнительных строчных букв. Компоненты классического пути обозначают латинской буквой «С» и арабскими цифрами (C1, C2 … C9), для субкомпонентов комплемента и продуктов расщепления к соответствующему обозначению добавляют строчные латинские буквы (C1q, C3b и т.д.). Активированные компоненты выделяют чертой над литерой, инактивированные компоненты – буквой «i» (например, iC3b).
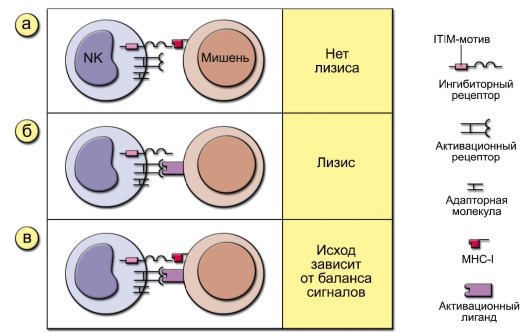
Рис. 3-4. Гипотеза «missing self» (отсутствие своего). На рисунке представлены три типа взаимодействия NK-клеток с мишенями. На NK-клетках имеется два типа распознающих рецепторов: активационные и ингибиторные. Ингибиторные рецепторы различают молекулы MHC-I и угнетают сигнал от активационных рецепторов, которые, в свою очередь, определяют либо молекулы MHC-I (но с меньшей аффинностью, чем ингибиторные рецепторы), либо MHC-подобные молекулы: а – клетка-мишень не экспрессирует активационных лигандов, и лизиса не происходит; б – клетка-мишень экспрессирует активационные лиганды, но не экспрессирует MHC-I. Такая клетка подвергается лизису; в – клеткамишень содержит как молекулы MHC-I, так и активационные лиганды. Исход взаимодействия зависит от баланса сигналов, идущих от активационных и ингибиторных рецепторов NK-клеток
• Активация комплемента (рис. 3-5). В норме, когда внутренняя среда организма «стерильна» и патологического распада собственных тканей не происходит, уровень активности системы комплемента невысок. При появлении во внутренней среде микробных продуктов происходит активация системы комплемента. Она может происходить по трём путям: альтернативному, классическому и лектиновому.
– Альтернативный путь активации. Его инициируют непосредственно поверхностные молекулы клеток микроорганизмов [факторы альтернативного пути имеют буквенное обозначение: P (пропердин), B и D].
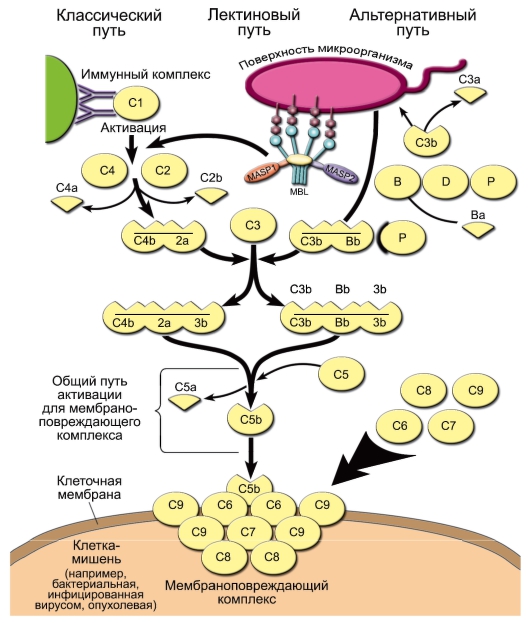
Рис. 3-5. Активация системы комплемента и образование мембраноатакующего комплекса. Пояснения см. в тексте, а также в табл. 3-2, 3-3. Активированные компоненты, согласно международному соглашению, надчёркнуты

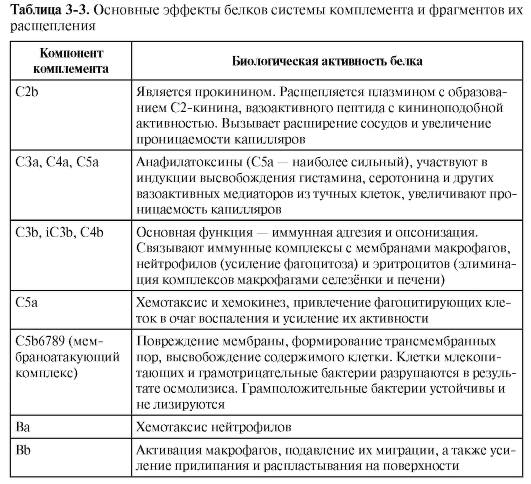
◊ Из всех белков системы комплемента в сыворотке крови больше всего C3 – его концентрация в норме составляет 1,2 мг/мл. При этом всегда имеется небольшой, но значимый уровень спонтанного расщепления C3 с образованием C3a и C3b. Компонент C3b – опсонин, т.е. он способен ковалентно связываться как с поверхностными молекулами микроорганизмов, так и с рецепторами на фагоцитах. Кроме того, «осев» на поверхности клеток, C3b связывает фактор В. Тот, в свою очередь, становится субстратом для сывороточной сериновой протеазы – фактора D, который расщепляет его на фрагменты Ва и Bb. C3b и Bb образуют на поверхности микроорганизма активный комплекс, стабилизируемый пропердином (фактор Р).
◊ Комплекс C3b/Bb служит С3-конвертазой и значительно повышает уровень расщепления С3 по сравнению со спонтанным. Кроме того, после связывания с C3 он расщепляет C5 до фрагментов C5a и C5b. Малые фрагменты C5a (наиболее сильный) и C3a – анафилатоксины комплемента, т.е. медиаторы воспалительной реакции. Они создают условия для миграции фагоцитов в очаг воспаления, вызывают дегрануляцию тучных клеток, сокращение гладких мышц. C5a также вызывает повышение экспрессии на фагоцитах CR1 и CR3.
◊ С C5b начинается формирование «мембраноатакующего комплекса», вызывающего перфорацию мембраны клеток микроорганизмов и их лизис. Сначала образуется комплекс C5b/C6/ C7, встраивающийся в мембрану клетки. Одна из субъединиц компонента C8 – C8b – присоединяется к комплексу и катализирует полимеризацию 10-16 молекул C9. Этот полимер и формирует неспадающуюся пору в мембране, имеющую диаметр около 10 нм. В результате клетки становятся неспособными поддерживать осмотический баланс и лизируются.
– Классический и лектиновый пути сходны друг с другом и отличаются от альтернативного способом активации C3. Главной C3конвертазой классического и лектинового пути служит комплекс C4b/C2a, в котором протеазной активностью обладает C2a, а C4b ковалентно связывается с поверхностью клеток микроорганизмов. Примечательно, что белок C2 гомологичен фактору В, даже их гены расположены рядом в локусе MHC-III.
◊ При активации по лектиновому пути один из белков острой фазы – MBL – взаимодействует с маннозой на поверхности клеток микроорганизмов, а MBL-ассоциированная сериновая протеаза (MASP – Mannose-bindingprotein-Associated Serine Protease) катализирует активационное расщепление C4 и C2.
◊ Сериновой протеазой классического пути служит C1s, одна из субъединиц комплекса C1qr2s2. Она активируется, когда по крайней мере 2 субъединицы C1q связываются с комплексом антиген-антитело. Таким образом, классический путь активации комплемента связывает врождённый и адаптивный иммунитет.
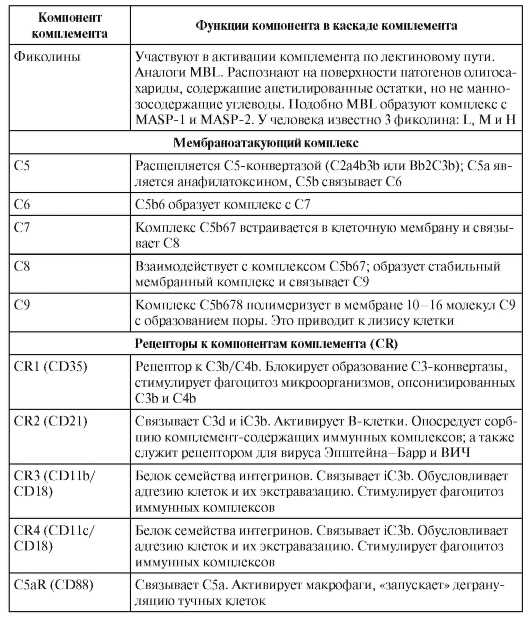
• Рецепторы компонентов комплемента. Известно 5 типов рецепторов для компонентов комплемента (CR – Complement Receptor) на различных клетках организма.
– CR1 экспрессирован на макрофагах, нейтрофилах и эритроцитах. Он связывает C3b и C4b и при наличии других стимулов к фагоцитозу (связывания комплексов антиген-антитело через FcyR или при воздействии ИФНу – продукта активированных T-лимфоцитов) оказывает пермиссивное действие на фагоциты. CR1 эритроцитов через C4b и C3b связывает растворимые иммунные комплексы и доставляет их к макрофагам селезёнки и печени, обеспечивая тем самым клиренс крови от иммунных комплексов. При нарушении этого механизма иммунные комплексы выпадают в осадок – прежде всего в базальных мембранах сосудов клубочков почек (CR1 есть и на подоцитах клубочков почек), приводя к развитию гломерулонефрита.
– CR2 B-лимфоцитов связывает продукты деградации C3 – C3d и iC3b. Это в 10 000-100 000 раз увеличивает восприимчивость B-лимфоцита к своему антигену. Эту же мембранную молекулу – CR2 – использует в качестве своего рецептора вирус Эпштейна-Барр – возбудитель инфекционного мононуклеоза.
– CR3 и CR4 также связывают iC3b, который, как и активная форма C3b, служит опсонином. В случае если CR3 уже связался с растворимыми полисахаридами типа бета-глюканов, связывания iC3b с CR3 самого по себе достаточно для стимуляции фагоцитоза.
– C5aR состоит из семи доменов, пенетрирующих мембрану клетки. Такая структура характерна для рецепторов, связанных с G-белками (белки, способные связывать гуаниновые нуклеотиды, в том числе ГТФ).
• Защита собственных клеток. Собственные клетки организма защищены от деструктивных воздействий активного комплемента благодаря так называемым регуляторным белкам системы комплемента.
– C1-ингибитор (C1inh) разрушает связь C1q с C1r2s2, тем самым ограничивая время, в течение которого C1s катализирует активационное расщепление C4 и C2. Кроме того, C1inh ограничивает спонтанную активацию C1 в плазме крови. При генетическом дефекте dinh развивается наследственный ангионевротический отёк. Его патогенез состоит в хронически повышенной спонтанной активации системы комплемента и избыточном накоплении анафилактинов (C3a и С5а), вызывающих отёки. Заболевание лечат заместительной терапией препаратом dinh.
– C4-связывающий белок – C4BP (C4-Binding Protein) связывает C4b, предотвращая взаимодействие C4b и С2а.
– DAF (Decay-Accelerating Factor – фактор, ускоряющий деградацию, CD55) ингибирует конвертазы классического и альтернативного путей активации комплемента, блокируя формирование мембраноатакующего комплекса.
– Фактор H (растворимый) вытесняет фактор В из комплекса с C3b.
– Фактор I (сывороточная протеаза) расщепляет C3b на C3dg и iC3b, а C4b – на C4c и C4d.
– Мембранный кофакторный белок MCP (Membrane Cofactor Protein, CD46) связывает C3b и C4b, делая их доступными для фактора I.
– Протектин (CD59). Связывается с C5b678 и предотвращает последующее связывание и полимеризацию С9, блокируя тем самым образование мембраноатакующего комплекса. При наследственном дефекте протектина или DAF развивается пароксизмальная ночная гемоглобинурия. У таких больных эпизодически возникают приступы внутрисосудистого лизиса собственных эритроцитов активированным комплементом и происходит экскреция гемоглобина почками.
ФАГОЦИТОЗ
Фагоцитоз – особый процесс поглощения клеткой крупных макромолекулярных комплексов или корпускулярных структур. «Профессиональные» фагоциты у млекопитающих – два типа дифференцированных клеток – нейтрофилы и макрофаги, которые созревают в костном мозге из СКК и имеют общую промежуточную клетку-предшественник. Сам термин «фагоцитоз» принадлежит И.И. Мечникову, который описал клетки, участвующие в фагоцитозе (нейтрофилы и макрофаги), и основные стадии фагоцитарного процесса: хемотаксис, поглощение, переваривание.
Нейтрофилы составляют значительную часть лейкоцитов периферической крови – 60-70%, или 2,5-7,5х109 клеток в 1 л крови. Нейтрофилы формируются в костном мозге, являясь основным продуктом миелоидного кроветворения. Они покидают костный мозг на предпоследней стадии развития – палочкоядерной форме, или на последней – сегментоядерной. Зрелый нейтрофил циркулирует 8-10 ч и поступает в ткани. Общая продолжительность жизни нейтрофила –
2-3 сут. В норме нейтрофилы не выходят из сосудов в периферические ткани, но они первыми мигрируют (т.е. подвергаются экстравазации) в очаг воспаления за счёт быстрой экспрессии молекул адгезии – VLA-4 (лиганд на эндотелии – VCAM-1) и интегрина CD11b/CD18 (лиганд на эндотелии – ICAM-1). На их наружной мембране выявлены эксклюзивные маркёры – CD66а и CD66d (раково-эмбриональные антигены). На рисунке 3-6 представлено участие нейтрофилов в фагоцитозе (миграция, поглощение, дегрануляция, внутриклеточный киллинг, деградация, экзоцитоз и апоптоз) и основные процессы, происходящие в этих клетках при активации (хемокинами, цитокинами и микробными веществами, в частности РАМР) – дегрануляция, образование активных форм кислорода и синтез цитокинов и хемокинов. Апоптоз нейрофилов и их фагоцитоз макрофагами можно рассматривать как важную составную часть воспалительного процесса, так как своевременное их удаление препятствует деструктивному действию их ферментов и различных молекул на окружающие клетки и ткани.
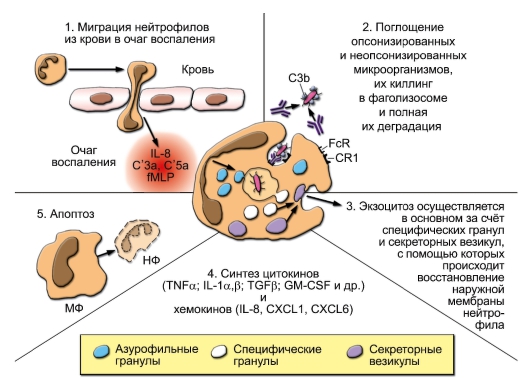
Рис. 3-6. Основные процессы, происходящие в нейтрофилах (НФ) при их активации и фагоцитозе
Моноциты и макрофаги. Моноциты являются «промежуточной формой», в крови их 5-10% от общего числа лейкоцитов. Их назначение – стать оседлыми макрофагами в тканях (рис. 3-7). Макрофаги локализуются в определённых участках лимфоидной ткани: медуллярных тяжах лимфатических узлов, красной и белой пульпы селезёнки. Клетки, производные моноцитов, присутствуют практически во всех нелимфоидных органах: клетки Купфера в печени, микроглия нервной системы, альвеолярные макрофаги, клетки Лангерганса кожи, остеокласты, макрофаги слизистых оболочек и серозных полостей, интерстициальной ткани сердца, поджелудочной железы, мезангиальные клетки почек (на рисунке не показаны). Макрофаги способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы. Макрофаги
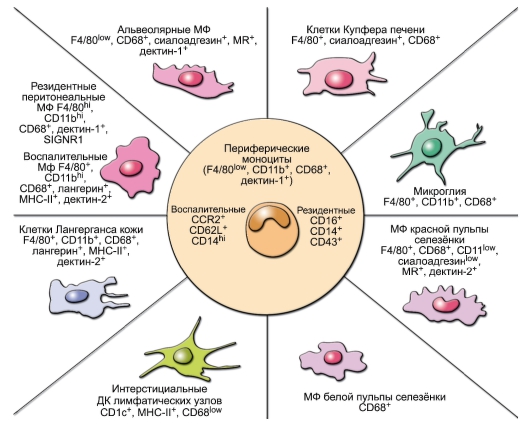
Рис. 3-7. Гетерогенность клеток, происходящих от моноцитов. Тканевые макрофаги (МФ) и дендритные клетки (ДК) происходят от моноцитов (МН) периферической крови
слизистых оболочек играют ведущую роль в защите организма. Для реализации этой функции они имеют набор распознающих рецепторов, кислородозависимые и кислородонезависимые механизмы киллинга микроорганизмов. Существенную роль в защите организма от инфекции играют макрофаги альвеолярные и слизистой оболочки кишечника. Первые «работают» в относительно бедной опсонинами среде, поэтому они экспрессируют большое количество паттернраспознающих рецепторов, включая скавенджер-рецепторы, маннозные рецепторы, β-глюканспецифические рецепторы, дектин-1 и др. При микробной инфекции в очаг проникновения микробов дополнительно мигрирует большое число воспалительных моноцитов, способных дифференцироваться в различные клеточные линии в зависимости от цитокинового окружения.
Рецепторы мембраны макрофагов
• CD115 (CSF-1R) – рецептор для моноцитарного колониестимулирующего фактора (M-CSF). Присутствует также на мембране полипотентной клетки-предшественника гранулоцитов и моноцитов и унипотентного предшественника моноцитов.
• Рецепторы клеточной мембраны макрофагов, участвующие в процессе фагоцитоза.
– CD14 – рецептор для комплексов бактериальных ЛПС с белками сыворотки крови, связывающими ЛПС (LBP), а также липоарабиноманнана клеточной стенки микобактерий и липотейхоевой кислоты грамположительных бактерий.
– Рецепторы для фрагментов фосфолипидных мембран и других компонентов собственных повреждённых и умирающих клеток (рецепторы-«мусорщики», scavenger receptors). Таков, например, CD163 – рецептор для «старых» эритроцитов.
– Рецептор, связывающий маннозу (Macrophage Mannose Receptor). Присутствует на мембране тканевых макрофагов и через маннозосодержащие поверхностные структуры связывает бактерии, вирусы и грибки.
– Рецепторы для комплемента – CR3 (интегрин CD11b/CD18) и CR4 (интегрин CD11c/CD18). Помимо комплемента они связывают и ряд бактериальных продуктов: ЛПС, липофосфогликан Leishmania, гемагглютинин из филаментов Bordetella, поверхностные структуры дрожжевых клеток Candida и грибков Histoplasma.
– CD64 – рецептор для Fc-фрагментов IgG – FcγRI (Fcy-рецептор первого типа), обеспечивающий фагоцитоз макрофагами иммунных комплексов. Сила связывания FcyRI с иммуноглобулинами различных изотипов убывает в ряду: IgG3 > IgG1 > IgG4 >
IgG2.
• Рецепторы, осуществляющие взаимодействие с лимфоцитами. Наряду с уже упомянутым CD64 к ним относят:
– рецепторы для цитокинов, вырабатываемых активированными лимфоцитами. Связывание с ИФНу и фактором некроза опухоли (ФНО) активирует макрофаг. Через рецептор для ИЛ-10 макрофаг, напротив, инактивируется;
– CD40, B7, MHC-II – мембранные молекулы для контактов с комплементарными мембранными молекулами лимфоцитов, т.е. для непосредственных межклеточных взаимодействий. У нейтрофилов такие рецепторы отсутствуют.
Последствия фагоцитоза. После того как фагоцит охватывает своей мембраной поглощаемый объект и заключает его в мембранную везикулу, называемую фагосомой, происходят следующие события.
• Расщепление фагоцитированного материала. Этот процесс идёт по одинаковым биохимическим механизмам во всех фагоцитах.
– Лизосомы – специальные внутриклеточные органеллы, содержащие набор гидролитических ферментов (кислых протеаз и гидролаз) с оптимумом pH порядка 4,0. В клетке лизосомы сливаются с фагосомами в фаголизосому, где и происходят реакции расщепления поглощённого материала.
– Ферментные системы. НАДФ-Н-оксидазы, супероксиддисмутаза, NO-синтазы, генерируют активные формы неорганических окислителей, участвующих в деструкции фагоцитированного объекта: пероксид водорода (Н2О2), супероксид анион (О2–), синглетный кислород (1O2), радикал гидроксила (OH–), гипохлорид (OCl–), оксид азота (NO). Активация НАДФ-Н-оксидазы приводит к формированию так называемого «кислодородного взрыва» (рис. 3-8). Первичным продуктом «кислородного взрыва» является супероксидный анион О2–, который образуется при переносе НАДФ-H-оксидазой электрона на кислород. Супероксидный анион обладает слабым бактерицидным эффектом и является недолговечным. В результате реакции, катализируемой ферментом супероксидисмутазой (СОД), из двух молекул супероксидного аниона формируется перекись водорода, обла-
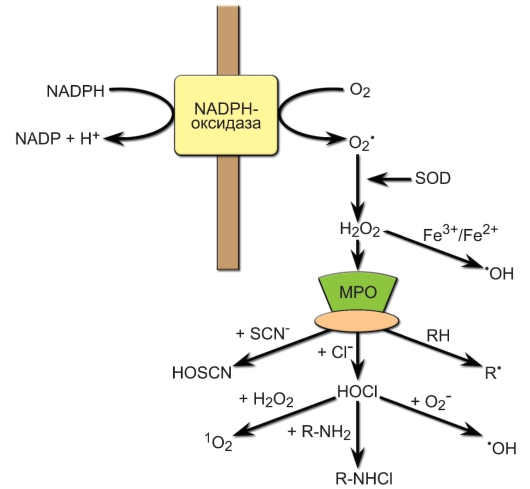
Рис. 3-8. Образование активных форм кислорода фагоцитами («кислородный взрыв»). Обозначения: NADPH-оксидаза – НАДФ-Н-оксидаза, NADP – НАДФ
дающая сильным микробицидным эффектом. При окислении хлоридов перекисью водорода в присутствии миелопероксидазы (МПО) образуется мощный цитотоксический агент – гипохлорная кислота HOCl, при её окислении супероксидным радикалом – гидроксильный радикал ОН, при окислении гипохлорит-иона перекисью водорода формируется синглетный кислород 1О2, который является источником образования другого бактерицидного вещества – озона О3 (на рис. не показан). При взаимодействии гипохлорной кислоты с аминогруппой
формируется микробицидное производное монохлорамина – R-NHCl.
• Секреция литических ферментов и окислительных радикалов в межклеточное пространство, где они также оказывают бактерицидное действие, но при этом поражают и собственные ткани. Нейтрофилы, помимо уже названных веществ, продуцируют и секретируют коллагеназу, катепсин G, желатиназу, эластазу и фосфолипазу A2.
• Образование и секреция цитокинов. Макрофаги и нейтрофилы, активированные продуктами микроорганизмов, начинают продуцировать цитокины и другие биологически активные медиаторы, инициирующие воспалительные реакции в очаге проникновения чужеродных агентов, подготавливая возможность развития адаптивного иммунного ответа.
– Макрофаги продуцируют интерлейкины (ИЛ-1, ИЛ-6, ИЛ-12); хемокин ИЛ-8; фактор некроза опухоли а (ФНОа); простагландины; лейкотриен В4 (LTB4); фактор, активирующий тромбоциты (ФАТ).
– Нейтрофилы продуцируют ФНОа, ИЛ-12, хемокин ИЛ-8, LTB4
и ФАТ.
• Процессинг и презентация антигена – образование внутри клеток комплексов из продуктов расщепления фагоцитированного материала с собственными молекулами MHC-II и экспрессия этих комплексов на поверхности клетки для презентации антигенов T-лимфоцитам. Этот процесс осуществляется АПК: ДК, макрофагами и др.
ЭНДОГЕННЫЕ ПРОТИВОМИКРОБНЫЕ ПЕПТИДЫ – ПРИРОДНЫЕ АНТИБИОТИКИ
Пептиды, обладающие активностью антибиотиков, обнаружены в клетках многих эукариот – от растений до человека. Они образуются путём процессинга более крупных белков-предшественников и содержат 13-80 аминокислотных остатков. Изучение противомикробных пептидов в настоящее время – это одно из самых новых направлений исследований. В базе данных о пептидах-антибиотиках содержится свыше 1200 наименований.
Выделяют несколько групп пептидов-антибиотиков, из которых для человека важны так называемые дефензины – пептиды, содер-
жащие несколько цистеинов, между которыми сформированы 3 дисульфидные связи. α-Дефензины содержатся в гранулах нейтрофилов. Синтез β-дефензинов происходит в клетках покровных тканей – эпителия дыхательных путей и пищеварительного тракта (рис. 3-9). Главными источниками α-дефензинов I-IV типов являются нейтрофилы и макрофаги, α-дефензинов V-VI типов – клетки Пеннета кишечника; β-дефензинов – эндотелиоциты и кератиноциты. Дефензины являются многофункциональными агентами, играющими важную роль в процессе фагоцитоза и воспаления. Первый эффект – способность убивать бактерии, грибы, оболочечные вирусы. Он может реализовываться внутриклеточно (в фаголизосоме) и внеклеточно. В результате экзоцитоза довольно большие концентрации дефензинов могут накапливаться в воспалительном очаге. Дефензины индуцируют синтез ИЛ-8 и сами являются хемоаттрактантами. Они оказывают ряд не-
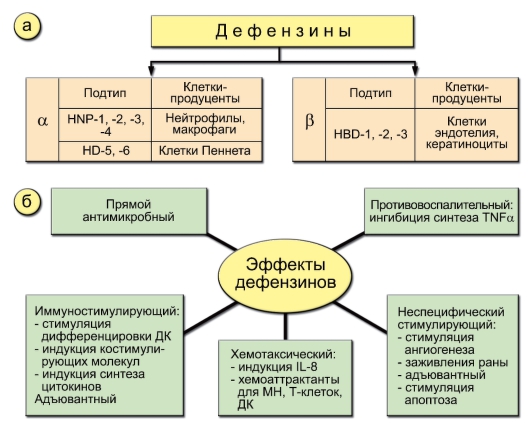
Рис. 3-9. Дефензины и их роль в процессе воспаления и фагоцитоза: а – источники дефензинов; б – эффекты дефензинов. Обозначения: МН – моноциты
специфических эффектов: стимулируют ангиогенез, заживление ран, индуцируют апоптоз и ингибируют синтез ФНОа, что важно на заключительных этапах воспаления. Вместе с тем дефензины стимулируют дифференцировку ДК.
Генетические дефекты пептидов-антибиотиков или необходимых для их функционирования кофакторов (например, ионных каналов, так как активность пептидов-антибиотиков «высокочувствительна» к ионной силе), вероятно, коррелируют с развитием прогредиентно текущей хронической патологии с инфекционными факторами в этиологии. Например, на сегодняшний день доказана связь развития муковисцидоза с мутацией гена регулятора мембранной проводимости CFTR, которая, возможно, определяет снижение активности β-дефензина в эпителии дыхательных путей.
ИНТЕРФЕРОНЫ ТИПА I
Как факторы противовирусной защиты интерфероны были открыты в 1957 г. А. Isaacs и J. Lindenmann. Выделяют интерфероны I, II и III типов. У человека тип I включает ИФНα, ИФНβ, ИФНκ, ИФНω, ИФНε. Главная роль во врождённой защите от вирусов принадлежит ИФНα (включает 13 членов) и ИФНβ (представлен одним членом). ИФНα и ИФНβ состоят из одной α-спиральной цепи из 165 и 166 аминокислотных остатков соответственно. Гомология между цепями составляет около 70%. К интерферонам типа II относится ИФНγ, а к интерферонам III типа – интерфероноподобные цитокины ИФН-λ1 (ИЛ-29), ИФН-λ2 (ИЛ-28A) и ИФН-λ3 (ИЛ-28B).
Считают, что основной источник интерферонов типа I в организме – плазмоцитоидные ДК. Интерфероны – небольшие белки, синтезируемые в инфицированных вирусом клетках. Индуктором синтеза интерферонов служат молекулы двуспиральной РНК. Двуспиральная РНК может быть геномной РНК вирусов или промежуточным продуктом транскрипции у ДНК-содержащих вирусов. В клетках млекопитающих собственных двуспиральных РНК нет.
Интерфероны типа I связываются со специфическими рецепторами на поверхности многих типов клеток иммунной системы и стимулируют противовирусный и в некоторых случаях противоопухолевый иммунный ответ. Подробнее эти действия описаны ниже и представлены на рис. 3-10.
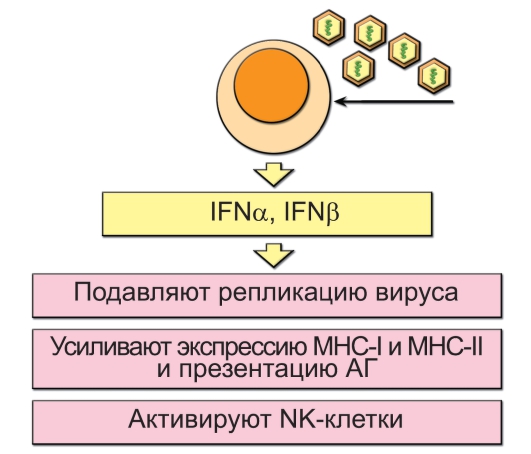
Рис. 3-10. Функции ИФНα/β
Влияние ИФНα/β на дендритные клетки и В-лимфоциты (рис. 3-11)
ИФНα/β стимулируют превращение незрелых ДК (1) в зрелые (2). Это приводит к усилению ими синтеза цитокинов, хемокинов, экспрессии молекул МНС, особенно I класса, костимуляторных молекул, экспрессии и секреции главных факторов выживания и активации В2клеток – BAFF и APRIL. Эти лиганды, взаимодействуя с рецепторами В-клеток BAFFR и TACI соответственно, при участии цитокинов ИЛ10, ТФРβ и ИЛ-15, синтезируемых активированными ДК, вызывают в наивных В-клетках (3) переключение иммуноглобулиновых генов CμСγ и Cμ-Сα и их созревание в IgG(4)- и IgA(5)-плазмабласты. ИФНα/β вызывают активацию макрофагов с теми же последствиями, что и для ДК (на рис. 3-11 не показано). ИФНα/β являются необходимыми цитокинами для созревания и пролиферации В1-клеток – главных продуцентов естественных аутоантител в организме.
Влияние ИФНα/в на Т-клетки (рис. 3-11)
ИФНα/β способствуют выживанию и пролиферации CD4+ и CD8+ T-клеток. ИФНα/β усиливают цитотоксические свойства CD8+Т-клеток, а также макрофагов и NK-клеток (на рис. 3-11 не показано). Вместе с тем ИФНα/β оказывают мощное антипролиферативное и проапоптозное действие, усиливая экспрессию проапоптотических молекул. Наличие одновременно пролиферативных и антипролиферативных свойств
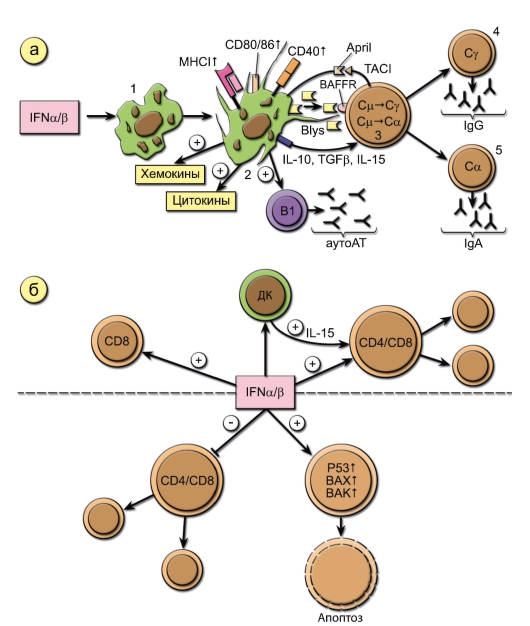
Рис. 3-11. Влияние ИФНα/β на клетки иммунной системы. Обозначения: Blys и April – факторы выживания и активации В2-клеток BAFF и APRIL; BAFFR и TACI – рецепторы В-клеток. Этапы 1-5 описаны в тексте
связано, вероятно, с включением на различных этапах инфекционного процесса или адаптивного иммунного ответа различных регуляторных механизмов, определяющих чувствительность клетки к действию ИФНа/р.
Интерфероны типа I индуцируют ферменты, нарушающие репликативный цикл вирусов:
• олигоаденилатсинтетазу, полимеризующую АТФ в 2′,5′-олигомеры (в норме нуклеотиды в нуклеиновых кислотах связаны по 3′,5′). Аномальные 2′,5′-олигомеры активируют эндорибонуклеазу, которая расщепляет их и заодно вирусные нуклеиновые кислоты;
• серинтреониновую киназу Р1 , фосфорилирующую фактор инициации синтеза белка эукариот eIF-2, что приводит к подавлению трансляции, в том числе и вирусных белков;
• белок MX – клеточный белок, необходимый для проявления резистентности клетки к размножению в ней вируса гриппа (по данным генетического нокаута гена mx).
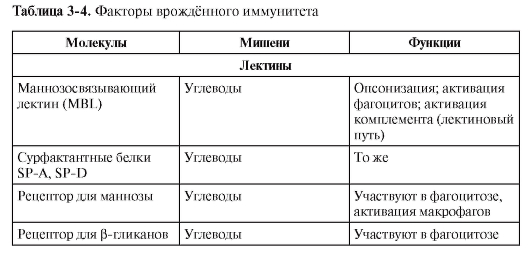
ФАКТОРЫ ВРОЖДЁННОГО ИММУНИТЕТА
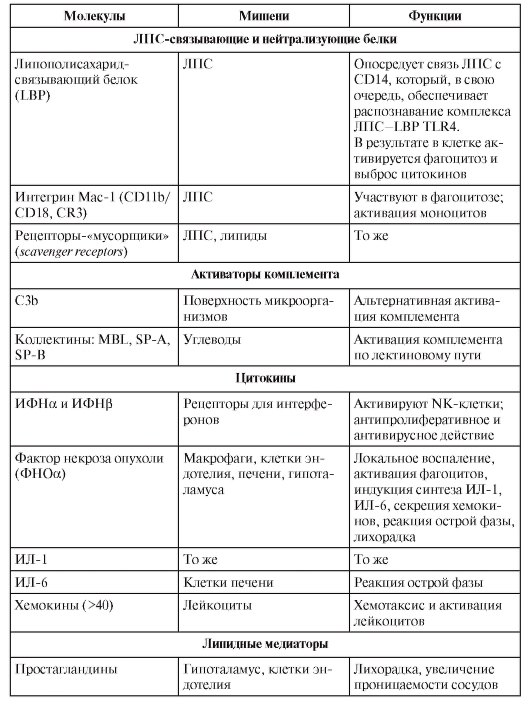
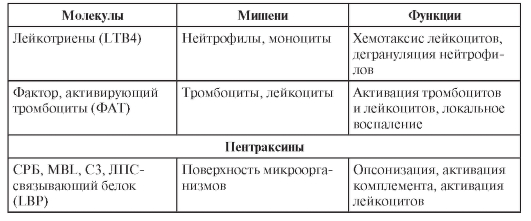
В табл. 3-4 перечислены различные факторы (молекулы) врождённой резистентности, относящиеся к разным функциональным классам (лектины, ЛПС-реактивные белки, активаторы комплемента, цитокины, липидные медиаторы, реактанты острой фазы, пентраксины).
Глава 4. ИММУННЫЙ ОТВЕТ
Механизмы врождённого иммунитета не всегда могут сдержать развитие инфекции. В таких случаях запускается адаптивный иммунный ответ. В отличие от врождённого иммунитета, реализуемого клетками, сформировавшимися в процессе онтогенеза независимо от контакта с патогенными микроорганизмами, адаптивный иммунный ответ развивается только в ответ на контакт с конкретным антигеном. При этом в иммунный ответ вовлекаются только клоны лимфоцитов, распознающие проникшие в организм чужеродные антигены. Эта специфическая адресная реакция называется иммунным ответом. Таким образом, иммунный ответ – многоэтапный процесс с обязательным участием лимфоцитов и других клеток иммунной системы.
Основные задачи иммунного ответа:
• распознавание лимфоцитами антигена в нативном состоянии (например, молекулы патогена) и представленного на поверхности модифицированных клеток (например, заражённых вирусами);
• деструкция патогена и повреждённых клеток;
• элиминация (выведение) продуктов деструкции из организма;
• формирование иммунной памяти.
В иммунном ответе выделяют индуктивную и эффекторную (продуктивную) фазы. В индуктивную фазу происходит презентация антигена, т.е. передача информации об антигене от клеток врождённого иммунитета (АПК) инициаторам адаптивного иммунитета – Т-хелперам. Затем выбирается путь дальнейшего развития иммунного ответа по клеточному или гуморальному пути: через индукцию дифференцировки разновидностей Т-хелперов (Th1, Th2, Th17 и других, см. главу 6). Наконец, при участии этих Т-хелперов происходит параллельная дифференцировка эффекторных клеток и клеток памяти. Эффекторная фаза иммунного ответа состоит в выполнении своих функций образовавшимися эффекторными клетками. Эта активность реализуется в форме клеточной или гуморальной иммунной защиты. В конце иммунного ответа благодаря включению регуляторных механизмов прогрессирование иммунных
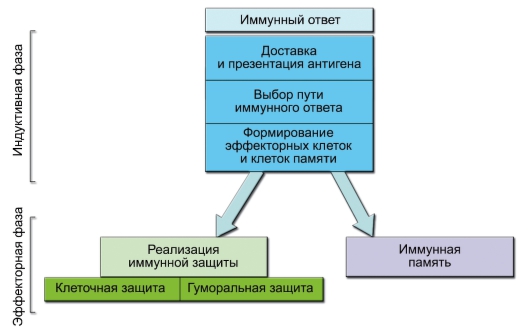
Рис. 4-1. Основные события иммунного ответа
реакций замедляется и в результате приводит к их прекращению. Дифференцировавшиеся в процессе иммунного ответа клетки памяти активируются только при повторной встрече с антигеном – при вторичном иммунном ответе. Он протекает в принципе так же, как первичный, но развивается быстрее и реализуется значительно эффективнее первичного (рис. 4-1).
ПРИЗНАКИ АДАПТИВНОГО ИММУННОГО ОТВЕТА
• Клоны лимфоцитов. Лимфоциты – единственный тип клеток в организме, при дифференцировке которых происходит обязательная рекомбинация ДНК в генах, кодирующих антигенраспознающие рецепторы. Таким образом, в организме непрерывно генерируется беспрецедентное разнообразие клонов лимфоцитов, несущих антигенраспознающие рецепторы различной специфичности. У Т-лимфоцитов возможно 1018 вариантов специфичностей и 1016 вариантов у B-лимфоцитов.
• Связывание антигенраспознающего рецептора лимфоцита со специфичным лигандом необходимо, но ещё недостаточно для инициации иммунного ответа.
• Корецепторы. Помимо антигенраспознающего рецептора на мембране лимфоцитов есть инвариантные корецепторы, строго необходимые для развития иммунного ответа.
• Для инициации иммунного ответа лимфоциту необходимо получить сигналы по «двум каналам» – от рецепторов для антигена и от корецепторов.
• Дополнительные активирующие сигналы через корецепторы поступают в лимфоциты от АПК (ДК, макрофагов, покровного эпителия и др.).
• Клетки врождённого иммунитета не имеют большого разнообразия рецепторов. Их рецепторы инвариантны, консервативны, кодируются зародышевыми генами, но именно эти рецепторы первыми избирательно связывают продукты микроорганизмов, отсутствующие у макроорганизмов. Таким образом, именно рецепторы клеток врождённого иммунитета – «носители эволюционной памяти», именно они первыми отличают «чужое» от «своего» и информируют лимфоциты о факте проникновения «чужого» во внутреннюю
среду.
• При инициации иммунного ответа в лимфоидных органах лимфоцит распознаёт антиген и связывает лиганд и затем под влиянием стимулирующих и костимулирующих сигналов активируется и пролиферирует. В-лимфоцит додифференцируется в лимфоидных органах в плазматические клетки, вырабатывающие специфичные к антигену антитела. Антителообразование происходит в том же лимфоидном органе, либо плазматические клетки мигрируют в костный мозг, где происходят те же самые процессы. Сенсибилизированные Т-лимфоциты, как и В-лимфоциты, мигрируют в очаг поражения в ткани (выходят из крови), где разрушают инфицированные клетки, либо выделяют цитокины, вовлекающие в эту деструкцию макрофаги, эозинофилы, нормальные киллеры и другие лейкоциты.
ЭТАПЫ РАЗВИТИЯ ИММУННОГО ОТВЕТА
• Началом процесса служит проникновение антигена во внутреннюю среду организма. В природе это происходит при повреждении покровных тканей. При этом в них выделяются определённые вещества (стресс-протеины, белки теплового шока, цитокины кератиноцитов и клеток соединительной ткани) – медиаторы воспа-
ления, которые и «подготавливают почву» для развития адаптивного иммунного ответа (если это потребуется). Попадание антигена без значимого нарушения целостности покровов сразу во внутреннюю среду – событие редкое. Чаще это происходит при искусственных вмешательствах, например при парентеральном введении веществ.
• Врождённые защитные реакции на антигены направлены на предотвращение проникновения антигенов глубже покровных тканей. В первую очередь это сосудистые реакции: расширение сосудов микроциркуляторного русла, повышенный выпот из сосудов в ткани плазмы или сыворотки (соответственно, и всех сывороточных неспецифических противоинфекционных факторов) и экстравазация лейкоцитов (в первую очередь фагоцитов-нейтрофилов). Локальный отёк препятствует проникновению антигенов в системную циркуляцию.
– Проникший в покровы патоген поглощают ДК и/или макрофаги при помощи эндоцитоза (чаще всего – фагоцитоза). И те, и другие – профессиональные АПК, однако ДК обладают особыми свойствами и мигрируют из покровов (вместе с антигенами) в региональные лимфоидные органы. ДК процессируют антигены, проходят этапы созревания, экспрессируют на мембране комплексы пептидов с молекулами MHC-II и необходимые корецепторные молекулы, с помощью которых они могут эффективно взаимодействовать с T-лимфоцитами в T-зависимых зонах периферических лимфоидных органов.
– Кроме АПК в покровных тканях с антигенами контактируют внутриэпителиальные лимфоциты, среди которых много γδT-клеток, распознающих непептидные антигены без предварительной презентации АПК. Под покровными тканями в плевральной и брюшной полостях присутствуют B1-лимфоциты, продуцирующие антитела с широкой перекрёстной реактивностью, специфичные в основном к распространённым бактериальным антигенам и аутоантигенам.
– Не «перехваченный» в барьерных тканях антиген может поступить непосредственно в системную циркуляцию. Тем не менее иммунный ответ на него ещё может развиться, поскольку АПК (ДК и макрофаги) присутствуют и в синусоидах селезёнки, через которую проходит весь объём крови.
• В T-зависимых зонах лимфатических узлов ДК презентируют антигены (в комплексе с MHC-II) интенсивно рециркулирую-
щим T-лимфоцитам, как бы проверяя их специфичность. Среди T-клеток рано или поздно встретится лимфоцит, несущий рецептор, специфичный к данному антигену. Если при этом состоятся все необходимые и достаточные корецепторные взаимодействия с АПК, T-лимфоцит получит активационный сигнал, что и станет началом собственно антигенспецифичного иммунного ответа.
– Двойное распознавание – процесс распознавания фрагментов пептидного антигена, в комплексе с молекулами МНС-I (CD8+ ЦТЛ) или МНС-II (CD4+ Т-хелпером). При этом Т-лимфоциты инициируют иммунный ответ против чужеродного антигена, презентированного АПК в комплексе со «своими» молекулами MHC-II или против клеток собственного организма, несущих вирусные или изменённые свои пептиды в комплексе с MHC-I.
• Распознавший антиген T-лимфоцит начинает пролиферировать и дифференцироваться. В результате образуется клон дифференцированных антигенспецифичных T-лимфоцитов. Такие T-клетки называют лимфоцитами-эффекторами. В процессе дифференцировки T-лимфоциты экспрессируют в надлежащем количестве мембранные молекулы и секретируют цитокины, необходимые для взаимодействия с B-лимфоцитами, лейкоцитами или для атаки клеток-мишеней.
• В T-зависимых зонах периферических лимфоидных органов происходит взаимодействие активированных антигеном T-лимфоцитов с активированными антигеном B-лимфоцитами.
• Провзаимодействовавшие с антигеном и с T-клетками B-лимфоциты мигрируют в зону лимфоидного фолликула, где пролиферируют и дифференцируются в антителопродуценты – плазматические клетки.
– Часть плазматических клеток остается в лимфатическом узле. Секретируемые ими антитела в значительном количестве связываются рецепторами для Fc-фрагмента антител (FcR) ФДК и в таком виде способны в течение продолжительного времени удерживать антиген в лимфоидном фолликуле.
– Остальные плазматические клетки уходят из фолликулов лимфоидных органов и мигрируют преимущественно в костный мозг или слизистые оболочки, где и осуществляют массовое образование антител, секретируя их в кровь или во внешнюю среду.
• Активированные Т-лимфоциты (ЦТЛ, Th1, Th2) выходят из региональных лимфатических узлов через эфферентные лимфатические сосуды, попадают в системную циркуляцию, а оттуда – в очаг воспаления в месте проникновения или диссеминации патогена.
• Если T-лимфоциты в очаге воспаления находят и связывают специфичный антиген, они начинают усиленно синтезировать и секретировать эффекторные молекулы – цитотоксины (ЦТЛ), непосредственно вызывающие гибель клеток-мишеней, или цитокины (Th1 или Th2), вовлекающие в деструкцию антигена другие лейкоциты (макрофаги, эозинофилы, тучные клетки, базофилы, нейтрофилы), в том числе различные популяции лимфоцитов.
• В конечной фазе иммунного ответа связанный антиген подвергается фагоцитозу и последующему разрушению гидролитическими ферментами, кислородными радикалами и радикалами оксида азота до мелких метаболитов, выводимых из организма через почки и пищеварительный тракт.
• Если санация организма от патогена/антигена завершается успешно – первый результат достигнут. После этого в норме происходит остановка продуктивного иммунного ответа – так называемая супрессия.
• Второй результат адаптивной иммунной реакции – формирование иммунной памяти. По современным представлениям лимфоцитами иммунной памяти становится незначительная часть покоящихся лимфоцитов (вероятно, единицы процентов), экспрессирующих особые ингибирующие активацию молекулярные структуры.
На рис. 4-2 представлена временная динамика иммунного ответа в различных проявлениях и с разными результатами.
МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ КЛЕТОК В ХОДЕ ИММУННОГО ОТВЕТА
При развитии иммунного ответа разные клетки взаимодействуют друг с другом. Известны как минимум 2 механизма такого взаимодействия:
• межклеточная адгезия (контактное взаимодействие) – мембранные молекулы одной клетки комплементарно связываются с мембранными молекулами другой клетки, что приводит к образованию межклеточного контакта;
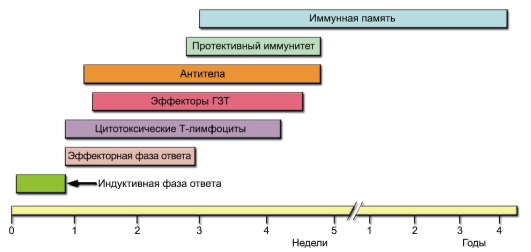
Рис. 4-2. Временная динамика проявлений адаптивной иммунной защиты при инфекции
• взаимодействие при помощи медиаторов – клетка секретирует особые растворимые молекулы (медиаторы), рецепторы к которым присутствуют на мембранах других клеток. При связывании рецептора с лигандом реализуется тот или иной биологический эффект. Медиаторы, участвующие в развитии иммунного ответа, называют цитокинами и хемокинами.
Молекулы межклеточной адгезии
К молекулам межклеточной адгезии относят селектины, адрессины, интегрины, молекулы суперсемейства иммуноглобулинов и ряд других.
• Селектины – трансмембранные белки на поверхности лимфоцитов, лейкоцитов, тромбоцитов и эндотелиоцитов. Общим для них является наличие во внеклеточной части лектиноподобного домена, способного комплементарно связывать сахара.
• Адрессины – муциноподобные молекулы на мембране эндотелиоцитов – лиганды для селектинов. Селектины и адрессины обеспечивают селективную адгезию клеток к стенке сосуда, необходимую для их экстравазации и дальнейшего проникновения в очаг поражения.
• Интегрины – гетеродимерные белки, состоящие из крупной а-цепи и меньшей по размеру в-цепи.
– LFA-1 (Lymphocyte Function-Associated antigen – антиген, ассоциированный с функцией лимфоцитов) – наиболее важный интегрин для активации любого T-лимфоцита. Антитела к LFA-1 способны блокировать активацию как наивных, так и покоящихся T-клеток. Однако анализ врождённых генетических дефектов молекул адгезии показывает, что другие интегрины (например, CD2) способны компенсировать отсутствие LFA-1.
– VLA (Very Late Activation antigens – очень поздние антигены активации). Эти интегрины экспрессируются T-лимфоцитами на 2-4-е сутки после активации и имеют наибольшее функциональное значение для проникновения уже стимулированной T-клетки в очаг воспаления, где ей надлежит организовать элиминацию антигена.
• ICAM (InterCellular Adhesion Molecules – молекулы межклеточной адгезии) относят к суперсемейству иммуноглобулинов.
– Взаимодействие молекул адгезии LFA-3 и ICAM-1 на клетках эпителия тимуса с комплементарными им молекулами CD2 и LFA-1 на тимоцитах необходимо для удержания последних в тимусе в процессе их дифференцировки.
– Наивные T-лимфоциты в T-зависимых зонах периферических лимфоидных органов взаимодействуют с АПК при помощи LFA-1, CD2 и ICAM-3 на T-клетках и ICAM-1, ICAM-2, LFA-1 и LFA-3 на АПК. Этого взаимодействия достаточно для запуска пролиферации распознавших антиген T-лимфоцитов и дифференцировки их в лимфоциты-эффекторы.
Данные по отдельным молекулам адгезии приведены в табл. 4-1.
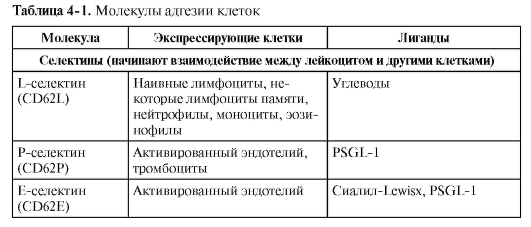
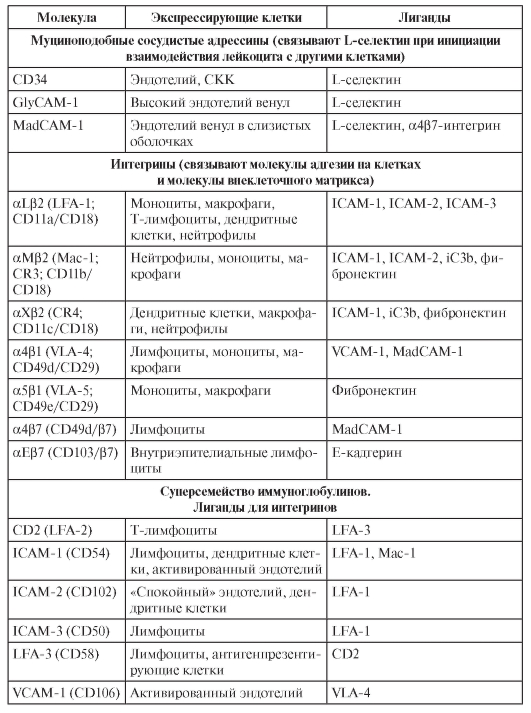
Цитокины
Взаимодействия, опосредованные цитокинами, более динамичны и оперативны, чем адгезивные. Для цитокинов характерны общие свойства.
• Разные типы клеток могут продуцировать одинаковые цитокины и экспрессировать рецепторы для них.
• Действие цитокинов избыточно. С одной стороны, разные цитокины могут вызывать внешне одинаковые реакции клеток, с другой – каждый цитокин индуцирует в разных клетках разные биологические эффекты.
• В подавляющем большинстве случаев цитокины – близкодействующие медиаторы, обусловливающие локальные взаимодействия клеток в очагах развития процессов в тканях.
– В зависимости от клетки-мишени выделяют аутокринные эффекты (действуют на саму клетку, секретировавшую цитокин) и паракринные эффекты (действуют на другие рядом расположенные клетки) цитокинов.
– Эндокринные (дистантные, или системные) эффекты проявляются, когда цитокин достигает клетки-мишени, циркулируя с кровью. У здоровых людей в крови обычно удаётся обнаружить множество разных цитокинов, включая интерфероны, но в концентрациях, не превышающих несколько пикограмм (10-12 г) в 1 мл. Системное действие выявлено в основном для четырёх цитокинов: ФНОа, ИЛ-1, ИЛ-6 и M-CSF, например при тяжёлой патологии типа септического шока, и опосредовано через гипоталамус и печень.
• Большинство цитокинов не депонируются в клетках, а синтезируются импульсно – «по запросу». Этот процесс начинается с транскрипции мРНК с соответствующего гена цитокина. Тем не менее небольшие количества ФНОα или других цитокинов могут депонироваться в гранулах нейтрофилов, тромбоцитов и тучных клеток.
• Матричная РНК цитокинов очень короткоживущая, что объясняет транзиторный характер их продукции клеткой: они вырабатываются непродолжительное время после получения «запроса» на их образование.
• Для действия цитокинов характерна каскадность, выражающаяся в том, что под влиянием одного цитокина клетка может начать вырабатывать другие цитокины (или тот же самый). Это приводит к усилению биологических эффектов.
• Каскад цитокинов саморегулируется: клетка, начавшая продуцировать активационные цитокины, через несколько часов или суток переключается на синтез супрессорных цитокинов и/или экспрессирует ингибиторные рецепторы либо рецепторы для сигналов к апоптозу.
По функциональному назначению выделяют 5 основных групп цитокинов (подробнее см. табл. 4-2).
Группа 1. Гемопоэтические цитокины регулируют пролиферацию и дифференцировку всех клеток кроветворной системы. К ним относят колониестимулирующие факторы – CSF (Colony Stimulating Factors): GM-CSF, M-CSF, G-CSF, эритропоэтин, тромбопоэтин, ИЛ-3 (мульти-CSF), ИЛ-5 (CSF для эозинофилов), ИЛ-7 (CSF для лимфоцитов), фактор стволовых клеток – SCF (Stem Cell Factor, его второе название «c-kit-лиганд»). К гемопоэтинам относят и ИЛ-1а под вторым названием – гемопоэтин-1, так как он поддерживает рост самых ранних клеток-предшественников кроветворения. Негативные регуляторы гемопоэза – ФНОа и трансформирующий фактор роста β (ТФРβ). Хемокин MIPα ингибирует ранние клетки-предшественники гемопоэза.
В процессе гемопоэза цитокины выступают в качестве факторов выживания и роста дифференцирующихся клеток-предшественников и их потомков, но не являются дифференцировочными факторами. Один и тот же цитокин может действовать на разных уровнях и в разных рядах дифференцировки. В миелоидном ряду проявляется правило, согласно которому влияние цитокинов (например, ИЛ-3, GM-CSF), действующих на ранних этапах развития клеток, сохраняется на поздних этапах развития, когда к «ранним» цитокинам присоединяются более специализированные факторы (такие, как G-CSF, M-CSF). В лимфоидном ряду первоначальное преобладание эффекта SCF постепенно замещается универсальным действием ИЛ-7, а на поздних этапах доминирующими наряду с ИЛ-7 становятся линейно-специфические факторы. На рис. 4-3 цитокины, контролирующие рост и выживание гемопоэтических клеток, показаны около стрелок, указывающих направление дифференцировки клеток-предшественников. Подробнее о функциях ИЛ-15, BAFF и Flt3L см. в табл. 4-2.
Группа 2. Первичные провоспалительные цитокины (цитокины врождённого иммунитета) – ИЛ-1а, ИЛ-1в, ФНОа и ИЛ-6. Они чрезвычайно плейотропны и действуют на клетки близлежащих тканей. Их продуцируют главным образом макрофаги и ДК покровных структур в очаге внедрения патогена. ИЛ-1 и ФНОа действуют преимущественно
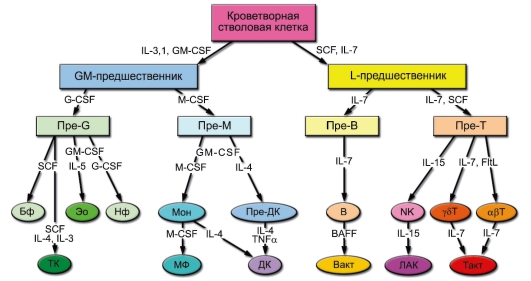
Рис. 4-3. Цитокиновый контроль гемопоэза. Обозначения: Бф – базофил; Эо – эозинофил; Нф – нейтрофил; Мон – моноцит; МФ – макрофаг; ТК – тучная клетка; ЛАК – лимфокин-активированный киллер; Вакт, Такт – активированные формы В- и Т-клеток соответственно; GM-предшественник – предшественник нейтрофильных гранулоцитов, моноцитов/макрофагов и ДК; пре-G – предшественник нейтрофильных гранулоцитов; пре-М – предшественник моноцитов/макрофагов; L-предшественник – предшественник лимфоцитов; Flt3L – Fms-like tyrosinekinase
локально (если нет септического заражения крови), а ИЛ-6 индуцирует биосинтез белков острой фазы в печени.
Группа 3. Иммунорегуляторные цитокины регулируют пролиферацию и дифференцировку T- и B-лимфоцитов и NK-клеток в периферических лимфоидных органах и тканях. В первую очередь их продуцируют активированные профессиональные АПК (макрофаги и ДК) и сами лимфоциты. К этой группе относят ИЛ-2 (митоген для лимфоцитов), ИЛ-4, ИЛ-12, ИЛ-15, ИФНγ.
Группа 4. Цитокины – медиаторы воспаления являются продуктами активированных T-лимфоцитов и вызывают активацию лейкоцитов «общевоспалительного назначения»: ИФНγ (активатор макрофагов и NK-клеток), ИЛ-5 (стимулирует пролиферацию В-лимфоцитов, а также индуцирует и активирует эозинофилы); лимфотоксины (активаторы нейтрофилов), в частности лимфотоксин-α (ФНОβ, по новой номенклатуре LTα), обеспечивающий образование воспалительных гранулем in vivo.
Группа 5. Противовоспалительные (иммуносупрессорные) цитоки-
ны. К ним относят ИЛ-10 (продуцируемый макрофагами и ингибирующий макрофаги) и ТФРβ (продуцируемый активированными CD4+ T-лимфоцитами и ингибирующий дальнейшую пролиферацию лимфоцитов). Кроме того, ИЛ-4 и ИЛ-13 – цитокины, ингибирующие макрофаги, а также в некоторых процессах выступающие в качестве противовоспалительных.
В табл. 4-2 приведена краткая характеристика некоторых цитокинов.
Хемокины
Среди цитокинов особое значение для иммуногенеза и модуляции воспаления имеют хемокины – небольшие (66-76 аминокислотных остатков) секреторные белки, регулирующие миграцию лейкоцитов. Кроме того, большинство хемокинов поддерживает ангиогенез и продукцию коллагенов клетками соединительной ткани – регенерацию. В настоящее время известно не менее 50 хемокинов, в том числе многие факторы хемотаксиса моноцитов и ИЛ-8. Считают, что при определённых условиях любая клетка организма продуцирует те или иные хемокины. Эти молекулы способны связываться не только со своими лигандами на мембране клетки-мишени, но и с молекулами межклеточного матрикса, создавая в нём градиент концентрации по мере приближения к клетке-продуценту хемокина.
Эти хемоаттрактанты имеют структурное сходство, в том числе в расположении остатков цистеина, образующих дисульфидные мостики. На основании расположения первых двух цистеиновых остатков выделяют 4 семейства хемокинов: CC, CXC, C и CX3C.
В табл. 4-3 приведена краткая характеристика некоторых известных на сегодняшний день хемокинов.
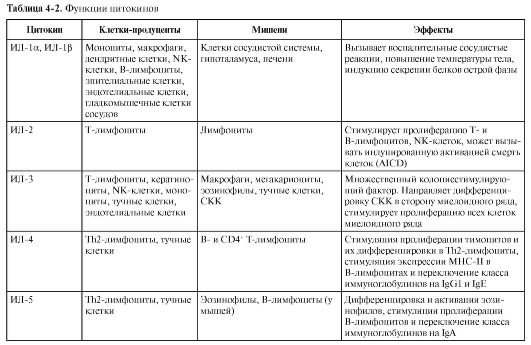
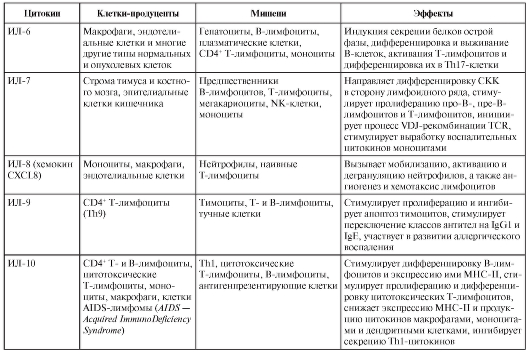
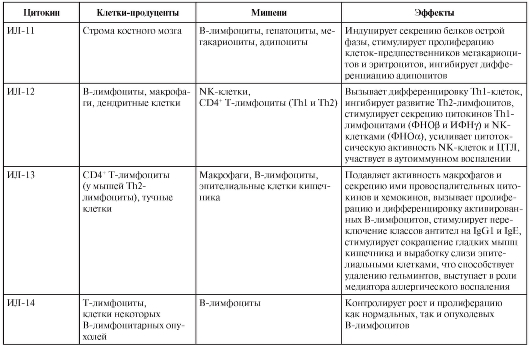
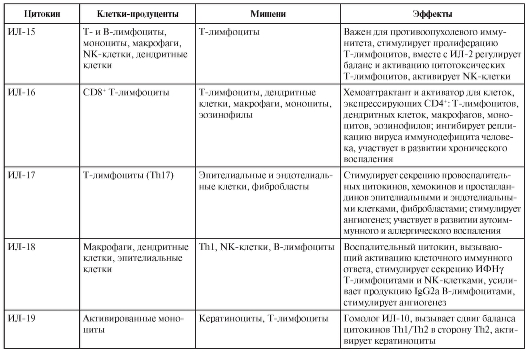
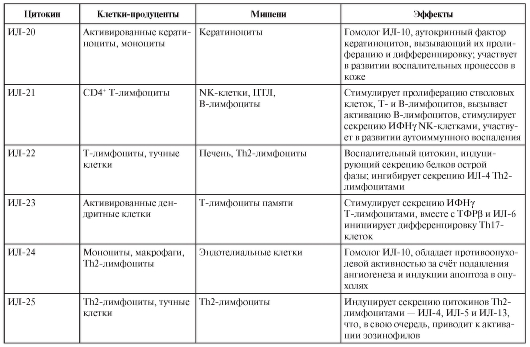
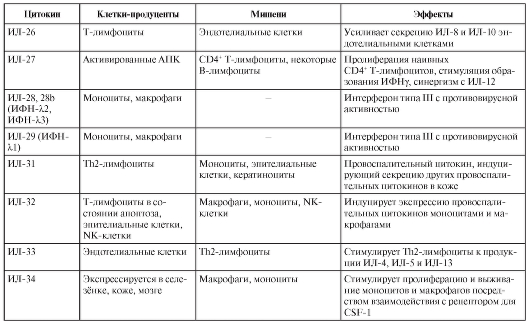
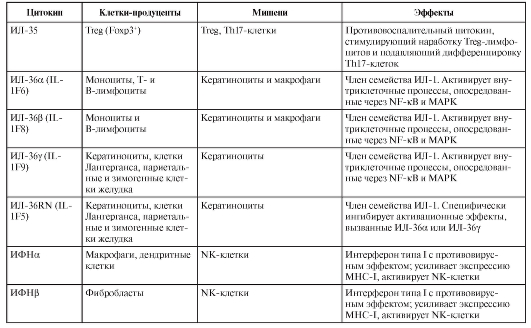
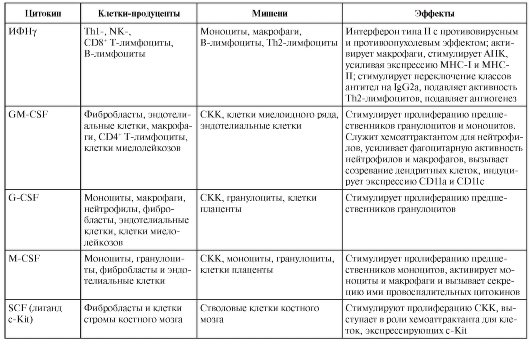
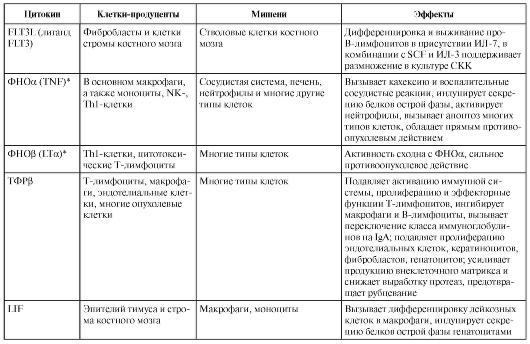
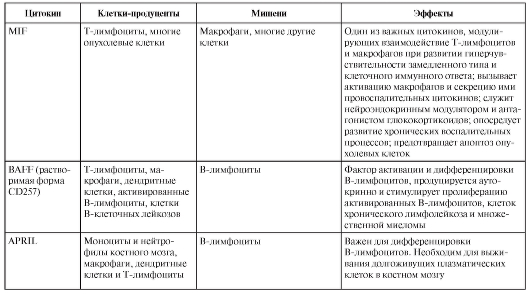
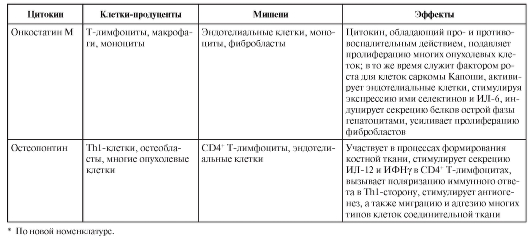
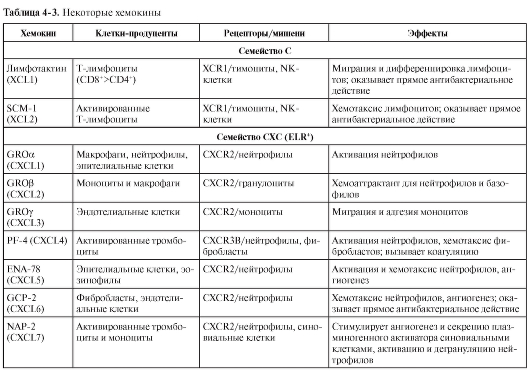
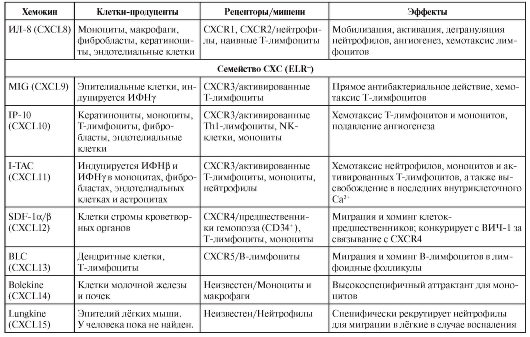
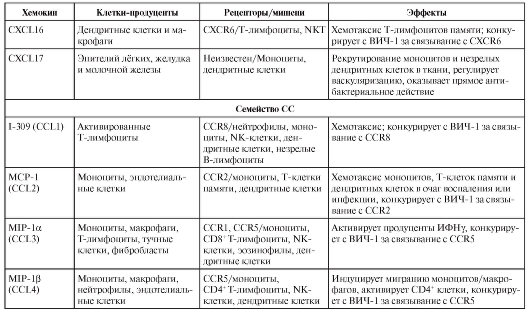
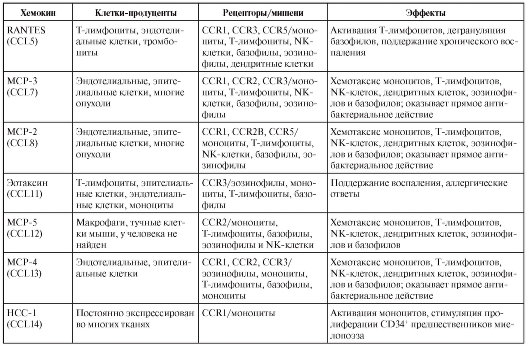
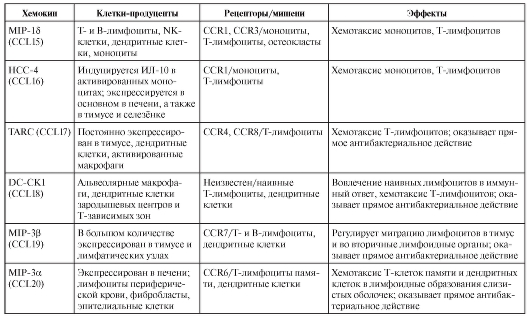
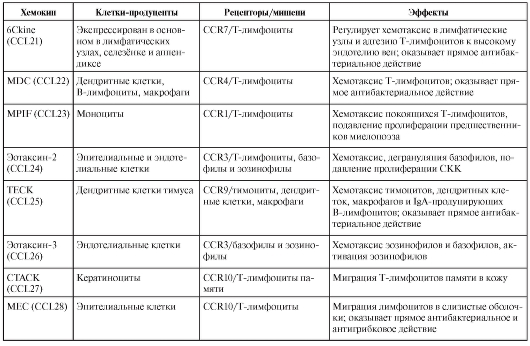
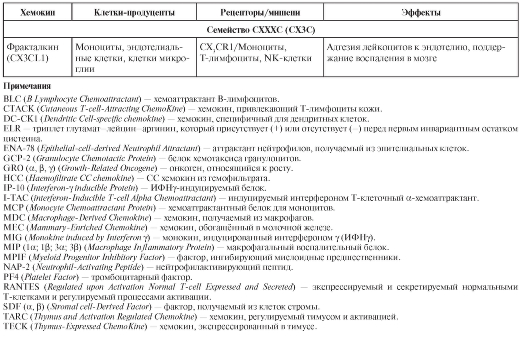
Рецепторы для цитокинов и хемокинов
Выделяют несколько семейств рецепторов для цитокинов (рис. 4-4).
• Семейство рецепторов гемопоэтических цитокинов представлено гетеродимерными молекулами и включает рецепторы для ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9 и ИЛ-15; рецептор для GM-CSF; рецептор для эритропоэтина; рецептор для гормона роста. Рецептор для ИЛ-2 существует в трёх формах, различающихся по составу субъединиц, а также по аффинности к ИЛ-2. Тример ИЛ-2Rαβγ обладает наибольшей аффинностью, димер ИЛ-2Rβγ – промежуточной и мономер ИЛ-2Rα – наименьшей (рис. 4-5).
• Семейство рецепторов интерферонов – гомодимерные трансмембранные молекулы. Помимо собственно рецепторов для интерферонов в семейство входит рецептор для ИЛ-10.
• Семейство рецепторов фактора некроза опухоли (TNFR – Tumor Necrosis Factor Receptor) включает молекулы, состоящие из одной трансмембранной полипептидной цепи: TNFR-I и TNFR-II, CD40, Fas (CD95), CD30, CD27, рецептор для фактора роста нервов (NGFR).
Путь проведения сигналов от рецепторов цитокинов (рис. 4-6) – самый короткий из известных, что соответствует физиологическим особенностям эффектов цитокинов (очень быстрые, но непродолжительные).
• Как правило, связывание цитокина с рецептором приводит к его диили тримеризации. Это вызывает конформационные из-
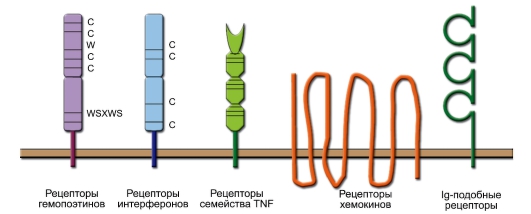
Рис. 4-4. Основные типы цитокиновых рецепторов. Обозначения аминокислотных остатков: С – цистеин, W – триптофан, S – серин, Х – любой остаток
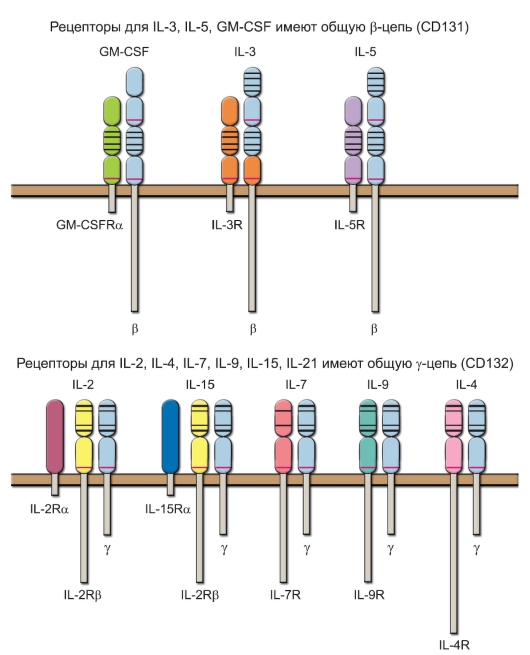
Рис. 4-5. Общие полипептидные цепи цитокиновых рецепторов
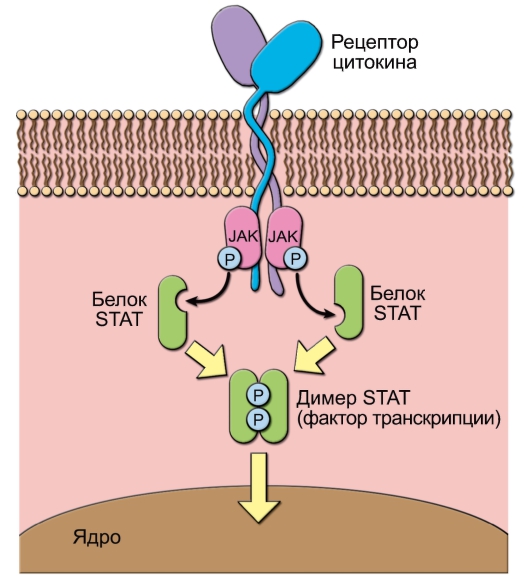
Рис. 4-6. Проведение сигналов от рецепторов для цитокинов (схема). Пояснения см. в тексте
менения, передающиеся связанным с полипептидными цепями рецептора тирозинкиназам семейства Janus, способными фосфорилировать их по остатку тирозина. Известно 4 члена этого семейства: Jak1, Jak2, Jak3, Tyk-2. • К фосфорилированным участкам рецептора могут присоединяться молекулы из семейства STAT (Signal Transducers and Activators of Transcription) – проводники сигналов и активаторы транскрипции. Описано 7 молекул STAT: STAT1, STAT2, STAT3, STAT4, STAT5а, STAT5b, STAT6.
– Те же киназы Janus (присоединившиеся к рецептору) фосфорилируют молекулы STAT по остатку тирозина в N-концевом домене.
– Фосфорилированные STAT отделяются от внутриклеточной части рецептора, образуют гомоили гетеродимеры и мигрируют в ядро, где связываются с ДНК и активируют транскрипцию.
Рецепторы для хемокинов принадлежат к семейству интегральных мембранных белков, содержащих семь спиральных доменов, семикратно пронизывающих клеточную мембрану; в это семейство входят также рецепторы для анафилатоксинов комплемента (C5a, C3a, C4a), фоторецепторы (родопсин и бактериородопсин) и множество других. Рецепторы этого семейства передают сигнал внутрь клетки через G-белки (ГТФ/ ГДФ-связывающие белки).
• Каждый G-белок состоит из трёх пептидных цепей – Gα,Gβ иGγ. В покое Gα-цепь образует комплекс с ГДФ. При связывании рецептора с лигандом ГДФ замещается на ГТФ и Gα-цепь диссоциирует от димера Gβ/Gγ (рис. 4-7).
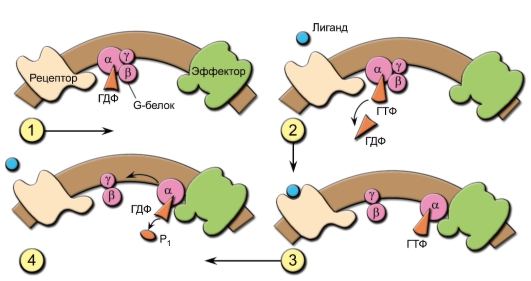
Рис. 4-7. Белок G: 1 – выключенное состояние: α-субъединица связана с гуанозиндифосфатом (ГДФ) и не контактирует с эффектором; 2 – при взаимодействии лиганда с рецептором ГДФ заменяется на ГТФ, G-белок активируется; 3 – G-белок диссоциирует, несущая ГТФ α-субъединица перемещается в мембране, связывается с эффектором и активирует его; 4 – α-субъединица превращает ГТФ в ГДФ, инактивируется и объединяется с другими субъединицами G-белка
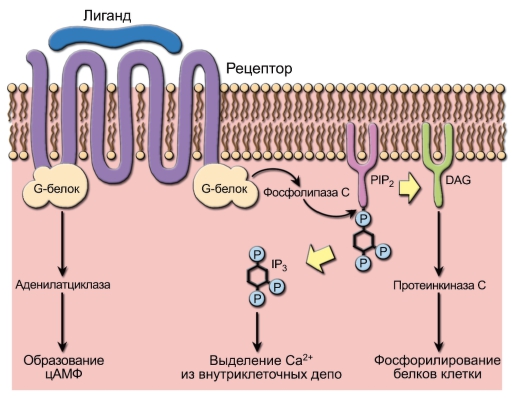
Рис. 4-8. Проведение сигналов с рецепторов семейства тетраспанинов. Роль инозиттрифосфата и диацилглицерина в реализации действия лигандов на клеткумишень. Образование комплекса лиганда-рецептор стимулирует G-белок, активирующий фосфолипазу С. Фосфолипаза С катализирует расщепление фосфатидил инозит-4,5-бифосфата (PIP2) на инозит-1,4,5-трифосфат (IP3) и диацилглицерин (DAG). Инозиттрифосфат (IP3) вызывает высвобождение Ca2+ из внутриклеточных депо. Ca2+-зависимая протеинкиназа С, активированная диацилглицерином (DAG), фосфорилирует белки клетки
• Ga-цепи различных G-белков имеют разные функции: одни активируют фосфолипазу Сγ, другие – аденилатциклазу, катализирующую образование циклического аденозинмонофосфата (цАМФ). Это приводит к разнообразным физиологическим эффектам, реализуемым посредством изменения режима функционирования ионных каналов, активации или блокирования разных биохимических реакций (рис. 4-8).
• Кроме того, Gα-цепь обладает ГТФазной активностью, что позволяет ей вновь объединиться с другими субъединицами G-белка и прекратить проведение сигнала.
ИММУННАЯ ПАМЯТЬ
Феномен иммунной памяти проявляется в том, что в случае успешной реализации иммунного ответа на патоген при его повторных попаданиях в организм санация осуществляется существенно быстрее и эффективнее, а патоген не успевает вызвать патологический инфекционный процесс. Это состояние известно как протективный иммунитет, т.е. иммунитет, защищающий от заболевания.
В основе феномена иммунной памяти лежит следующий факт: часть лимфоцитов (единицы процентов) антигенспецифичного клона, вовлечённого в первый иммунный ответ, «замораживается» и циркулирует в организме в течение неопределённого времени (для разных антигенов время очень различается – вплоть до продолжительности жизни всего организма).
В настоящее время неизвестно, какие именно молекулы и взаимодействия и на каком точно этапе иммуногенеза определяют формирование популяции лимфоцитов памяти. В то же время установлены различия лимфоцитов памяти от других субпопуляций тех же лимфоцитов.
• B-лимфоциты. B-лимфоциты памяти отличаются от плазматических клеток (терминальной стадии дифференцировки В-лимфоцитов) по ряду признаков.
– B-лимфоциты памяти несут поверхностные иммуноглобулины, экспрессируют молекулы MHC-II; способны к пролиферации, переключению изотипов иммуноглобулинов, гипермутированию гипервариабельных участков молекулы иммуноглобулина – CDR (Complementarity Determining Region), расположенных в V-домене (см. главу 5), но не способны к интенсивному образованию иммуноглобулинов. B-лимфоциты памяти находятся в покоящемся (неактивированном) состоянии.
– Плазматические клетки, напротив, способны к интенсивному синтезу/секреции иммуноглобулинов, но не несут поверхностные иммуноглобулины, не экспрессируют молекулы MHC-II; не способны к пролиферации, переключению между изотипами иммуноглобулинов, гипермутированию CDR V-доменов иммуноглобулинов.
• T-лимфоциты памяти отличаются от зрелых T-клеток и по частоте встречаемости антигенспецифичных клонов в лимфоидной ткани, и по экспрессии ряда мембранных молекул [LFA-3 (CD58); CD2; LFA-1 (CD11a/CD18); CD44; CD45RO] более чем в 10-100 раз. В отличие от наивных лимфоцитов, Т-клетки памяти испытывают
существенно меньшую потребность в медиаторах воспаления и в костимулирующих сигналах для запуска иммунного ответа на специфический антиген и могут отвечать при минимальных симптомах воспаления или даже при их отсутствии. В то же время наивные T-клетки, в отличие от T-лимфоцитов памяти, экспрессируют на поверхности CD45RA и большие количества молекул L-селектина, обеспечивающие хоминг Т-лимфоцитов в лимфатические узлы.
Вакцины
Целью вакцинации является индукция образования клеток памяти, специфичных к возбудителю. Это достигается посредством активации врождённого иммунитета и клонов В- и/или Т-клеточного звена адаптивного иммунитета. Основные проблемы вакцинации состоят в обеспечении безвредности вакцинного препарата при сохранении его иммуногенности. Тенденция заменить природные препараты антигенов (убитые, ослабленные патогены, экстракты активных субстанций) синтетическими препаратами или кодирующими их генами наталкивается на проблемы, связанные с недостаточной силой иммунного сигнала. Разновидности вакцин представлены на рис. 4-9.
Рис. 4-9. Разновидности вакцин
Глава 5. АНТИГЕНЫ. АНТИТЕЛА. B-ЛИМФОЦИТЫ
АНТИГЕН
Антиген – любая молекула (соединения разной химической природы: пептиды, углеводы, полифосфаты, стероиды), которая потенциально может быть распознана иммунной системой организма как чужеродная («не своя»). Таким образом, антиген – молекула, несущая признаки генетически чужеродной информации. В качестве синонима применяют также термин «иммуноген», подразумевая, что иммуноген (антиген) способен вызвать ответные реакции иммунной системы, в итоге приводящие к развитию приобретённого иммунитета. Способность вызывать такие ответные реакции (т.е. образование антител и сенсибилизацию – приобретение организмом чувствительности к антигену) присуща не всей молекуле антигена, а только особой её части, которую называют антигенной детерминантой, или эпитопом. У большинства белковых антигенов такую детерминанту образует последовательность из 4-8 аминокислотных остатков, а у полисахаридных антигенов – 3-6 гексозных остатков. Число детерминант у одного вещества может быть различным. Так, у яичного альбумина их не менее 5, у дифтерийного токсина – минимум 80, у тиреоглобулина – более 40. Различают экзогенные (поступающие в организм извне) и эндогенные антигены (аутоантигены – продукты собственных клеток организма), а также антигены, вызывающие аллергические реакции, – аллергены. О разновидностях антигенов см. ниже (Т-зависимые и Т-независимые антигены, суперантигены).
АНТИТЕЛА
Антитело – особый растворимый белок с определённой биохимической структурой – иммуноглобулин, который присутствует в сыворотке крови и других биологических жидкостях и предназначен для связывания антигена. В энциклопедическом словаре медицинских терминов
указано следующее определение: антитела («анти» + «тела») – глобулины сыворотки крови человека и животных, образующиеся в ответ на попадание в организм различных антигенов (принадлежащих бактериям, вирусам, белковым токсинам и др.) и специфически взаимодействующие с этими антигенами.
• Антитела связывают антиген. Существенным и уникальным свойством антител, отличающим их даже от TCR, служит их способность связывать антиген непосредственно в том виде, в каком он проникает в организм (в нативной конформации). При этом времени на предварительную метаболическую обработку антигена не требуется, поэтому антитела – очень важный фактор безотлагательной защиты организма (например, от сильных ядов, при укусах змей, скорпионов, пчёл и др.).
• Антитела конкретной специфичности синтезируются исключительно B-лимфоцитами одного клона. При дифференцировке каждый B-лимфоцит и его дочерние клетки (клон B-лимфоцитов) приобретают способность синтезировать единственный вариант антител с уникальной структурой антигенсвязывающего центра молекулы, т.е. имеет место клональность биосинтеза иммуноглобулинов.
• Множество антител. В то же время вся совокупность B-лимфоцитов организма способна синтезировать огромное разнообразие антител – около 106-109. Однако точно установить, сколько разных антигенов потенциально способно связать одно антитело, принципиально невозможно.
• Иммуноглобулины. Антитела – белки, имеющие глобулярную вторичную структуру, поэтому молекулы этого типа и названы иммуноглобулинами. Антитела принадлежат к суперсемейству иммуноглобулинов (рис. 5-1), куда входят также белки MHC, некоторые молекулы адгезии [LFA-2 (CD2), ICAM-1 (CD54), VCAM-1 (CD106) и др. (см. табл. 4-1)], TCR, отдельные рецепторы цитокинов [для ИЛ-1 типов I и II, ИЛ-6, M-CSF, c-kit (CD117)], рецепторы для Fc-фрагментов иммуноглобулинов (FcaR, FcyRI, FcyRII), мембранные молекулы CD3, CD4, CD8, CD80 и др.
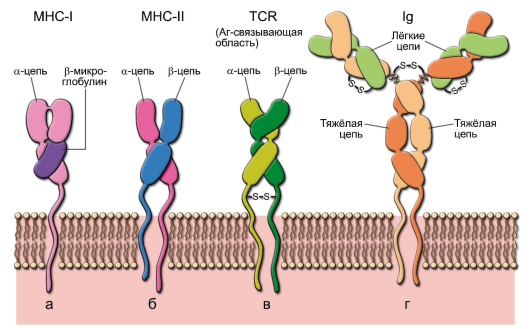
Рис. 5-1. Структура белков суперсемейства иммуноглобулинов: а – молекула MHC-I состоит из α-цепи, внемембранная её часть связана с короткой цепью β2-микроглобулина; б – молекула MHC-II состоит из двух субъединиц: более длинной α-цепи и β-цепи. Часть каждой цепи выступает над поверхностью клеточной мембраны, цепь содержит трансмембранный участок и небольшой фрагмент в цитоплазме; в – антигенсвязывающая область молекулы TCR состоит из двух цепей: α и β. Каждая цепь представлена двумя внеклеточными иммуноглобулинподобными доменами (вариабельным на NH-конце и константным), стабилизированными при помощи S-S-связей, и цитоплазматическим стабильным COOH-концом. SH-группа, присутствующая в цитоплазматическом фрагменте α-цепи, может взаимодействовать с мембранными или цитоплазматическими белками; г – мономер молекулы IgM, встроенный в плазматическую мембрану B-лимфоцитов, это рецептор для антигена. Разнообразие специфичностей TCR и иммуноглобулинов обеспечивается возможностью сайтспецифичной рекомбинации множества различных генных сегментов, кодирующих отдельные фрагменты молекулы
ИММУНОГЛОБУЛИНЫ
Иммуноглобулины [международная аббревиатура – Ig (Immunoglobulin)] – класс структурно связанных белков, содержащих 2 вида парных полипептидных цепей: лёгкие (L, от англ. Light – лёгкий), с низкой молекулярной массой, и тяжёлые (H, от англ. Heavy – тяжёлый), с высокой молекулярной массой. Все 4 цепи соединены вместе дисульфидными
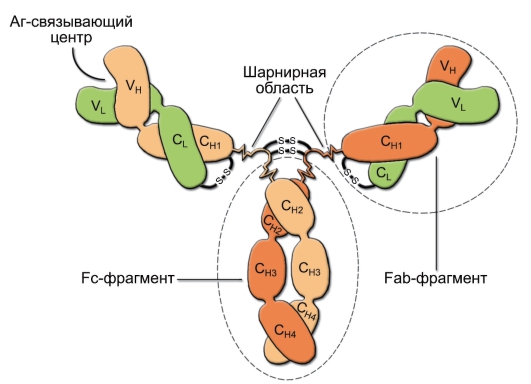
Рис. 5-2. Молекула иммуноглобулина. Обозначения: L – лёгкие цепи; H – тяжёлые цепи; V – вариабельная область; С – константная область. N-концевые области L- и Н-цепей (V-область) образуют 2 антигенсвязывающих центра – (Fab)2-фрагмент. Fc-фрагмент молекулы взаимодействует со своим рецептором на мембране различных типов клеток (макрофаги, нейтрофилы, тучные клетки)
связями. Принципиальная схема строения молекулы иммуноглобулина (мономер) приведена на рис. 5-2.
Классы иммуноглобулинов
На основании структурных и антигенных признаков Н-цепей иммуноглобулины подразделяют (в порядке относительного содержания в сыворотке крови) на 5 классов: IgG (80%), IgA (15%), IgM (10%), IgD (менее 0,1%), IgE (менее 0,01%). Заглавная латинская буква справа от «Ig» обозначает класс иммуноглобулина – М, G, А, Е или D. Молекулы IgG, IgD и IgE – мономеры, IgM – пентамер; молекулы IgA в сыворотке крови – мономеры, а в экскретируемых жидкостях (слёзная, слюна, секреты слизистых оболочек) – димеры (рис. 5-3).
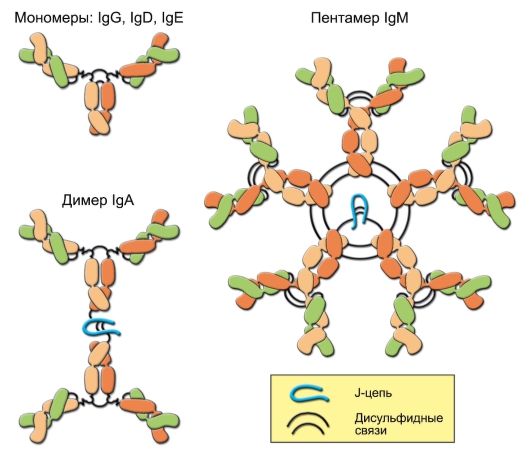
Рис. 5-3. Мономеры и полимеры иммуноглобулинов. J-цепь (от англ. joining – связывающая) связывает остатки цистеина на C-концах тяжёлых цепей IgM и IgA
• Подклассы. У человека иммуноглобулины классов G (IgG) и A (IgA)
имеют несколько подклассов: IgG1, IgG2, IgG3, IgG4 и IgA1, IgA2.
• Изотипы. Классы и подклассы иммуноглобулинов иначе называют изотипами (приставка «изо» означает то, что у всех представителей данного вида они одинаковы).
• Аллотипы. Индивидуальные аллельные варианты иммуноглобулинов в пределах одного изотипа называются аллотипами.
• Идиотипы. Идиотипические детерминанты находятся в активных центрах (антигенсвязывающих участках) антител, т.е. соединены с V-доменами, и служат маркёрами индивидуальньгх антител.
Данные о классах и подклассах иммуноглобулинов суммированы в табл. 5-1.
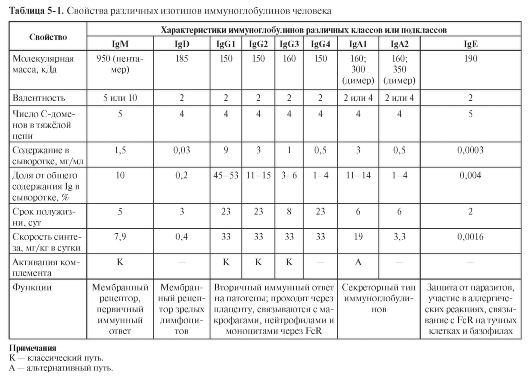
Структура иммуноглобулинов
• Фрагменты молекулы иммуноглобулина (см. рис. 5-2). Путём протеолитического расщепления папаином молекулы иммуноглобулина с последующей ионообменной хроматографией можно получить 3 фрагмента: 1 Fс-фрагмент и 2 Fab-фрагмента.
– Fab-фрагменты (Fragment, antigen binding – антигенсвязывающие фрагменты) – 2 одинаковых фрагмента, сохраняющих способность связывать антиген.
– Fc-фрагмент (Fragment crystallizable – кристаллизующийся фрагмент) – непарный, легко кристаллизуется. Fс-фрагменты иммуноглобулинов в пределах одного изотипа строго идентичны (независимо от специфичности антител). Они обеспечивают взаимодействие самих антител и комплексов антиген-антитело с системой комплемента, фагоцитами, эозинофилами, базофилами, тучными клетками. При этом каждый класс иммуноглобулинов взаимодействует только с определёнными эффекторными клетками или молекулами.
• Тяжёлые цепи определяют различия между классами иммуноглобулинов, поэтому разные типы тяжёлых цепей обозначают греческими буквами соответственно латинской аббревиатуре класса: для IgM – μ, для IgG – γ, для IgA – α, для IgE – ε, для IgD – δ. Каждая из H-цепей молекул IgG, IgD и IgA состоит из 4 доменов (см. рис. 5-2): вариабельного – VH и константных (CH1, CH2, CH3). H-цепи молекул IgM и IgE содержат дополнительный домен – СН4.
• Лёгкие цепи примыкают к N-концу тяжёлых цепей. Каждая L-цепь состоит из двух доменов – VL и CL. Известно 2 типа лёгких цепей иммуноглобулинов – κ и λ. Функциональные различия между иммуноглобулинами с лёгкими κ- или λ-цепями не выявлены.
• Домены. Вторичная структура полипептидных цепей представлена доменами (см. рис. 5-1), каждый из которых включает около 110 аминокислотных остатков.
– V-домены обеих цепей имеют сильно варьирующий аминокислотный состав (отсюда и их обозначение – Variable), что позволяет им связывать разные антигены.
◊ Гипервариабельные участки. Внутри V-доменов выделяют несколько гипервариабельных участков: CDR1, CDR2, CDR3 (CDR – от Complementarity Determining Region), т.е. области молекулы иммуноглобулина, определяющие её комплементарность антигену.
◊ Каркасные области. Промежутки между гипервариабельными участками обозначают как FWR (FrameWork Regions), т.е. каркасные области: FWR1, FWR2, FWR3 и FWR4. Помимо чисто «скелетной» для них характерны и другие функции, не связанные с распознаванием антигенов: FWR-участки V-области молекул иммуноглобулинов могут обладать ферментативной (протеазной и нуклеазной) активностью, связывать ионы металлов и суперантигены.
– C-домены. Остальные домены имеют строго инвариантный для каждого изотипа иммуноглобулинов аминокислотный состав и называются C-доменами (от Constant).
◊ В C-доменах и в FWR-участках V-доменов содержатся одинаковые аминокислотные последовательности, что рассматривают как молекулярное свидетельство их генетической общности.
◊ Гомологичные последовательности аминокислот присутствуют (помимо иммуноглобулинов) и в молекулах других белков, объединяемых с иммуноглобулинами в одно молекулярное суперсемейство иммуноглобулинов (см. выше и рис. 5-1).
Большое число возможных комбинаций L- и H-цепей создаёт многообразие антител каждого индивидуума.
• Формы иммуноглобулинов. Молекулы иммуноглобулинов одной и
той же специфичности присутствуют в организме в трёх формах:
растворимой, трансмембранной и связанной.
– Растворимая. В крови и других биологических жидкостях – секретируемый клеткой иммуноглобулин.
– Трансмембранная. На мембране B-лимфоцита в составе антигенраспознающего рецептора – BCR (B-Cell Receptor). Трансмембранные формы всех классов иммуноглобулинов (включая IgM и IgA) – мономеры.
– Связанная. Иммуноглобулины, за Fc-конец связанные с рецепторами клеток (макрофагами, нейтрофилами, эозинофилами и тучными). Все антитела, кроме IgE, могут фиксироваться рецепторами FcR клеток только в комплексе с антигеном.
Связывание антигена
Гипервариабельные участки V-области антитела (как и TCR) непосредственно и комплементарно связывают антиген с помощью ионных,
ван-дер-ваальсовых, водородных и гидрофобных взаимодействий (сил, связей).
• Эпитоп (антигенная детерминанта – см. выше) – участок молекулы антигена, непосредственно участвующий в образовании ионных, водородных, ван-дер-ваальсовых и гидрофобных связей с активным центром Fab-фрагмента.
• Сродство между антигеном и антителом количественно характеризуют понятиями «аффинность» и «авидность».
• Аффинность. Силу химической связи одного антигенного эпитопа с одним из активных центров молекулы иммуноглобулина называют аффинностью связи антитела с антигеном. Аффинность количественно принято оценивать по константе диссоциации (в моль-1) одного антигенного эпитопа с одним активным центром.
Так как у цельных молекул мономерных иммуноглобулинов присутствует по 2 потенциально равнозначных симметрично расположенных активных центра для связывания антигена, у димерного IgA – 4, а у пентамерного IgM – 10 (10 для гаптенов, а для большинства антигенов всего лишь 5), скорость диссоциации целой молекулы иммуноглобулина со всеми связанными эпитопами меньше, чем скорость диссоциации одного из активных центров.
• Авидность. Силу связи целой молекулы антитела со всеми антигенными эпитопами, которые ей удалось связать, называют авидностью связи антитела с антигеном.
ГЕНЫ ИММУНОГЛОБУЛИНОВ
Зародышевые гены иммуноглобулинов. У здорового человека В-лимфоциты в течение жизни создают несколько миллионов вариантов антител, связывающих разные антигены (потенциально 1016 антигенов). Никакой геном физически не несёт столько различных структурных генов. Количество наследуемого от родителей генетического материала (ДНК), определяющего биосинтез антител, не так уж и велико – немногим более 120 структурных генов. Это наследуемое множество генов – зародышевые гены иммуноглобулинов (зародышевая конфигурация генов).
Гены вариабельных доменов
Во всех соматических клетках, включая СКК, гены иммуноглобулинов находятся именно в зародышевой конфигурации, где гены
V-участков представлены в виде отдельных сегментов, расположенных друг относительно друга на значительном расстоянии и сгруппированных в несколько кластеров: собственно V (вариабельный), J (связующий), а у тяжёлых цепей также D (от англ. Diversity – разнообразие). Формирование разнообразия генов для миллионов вариантов V-участков молекул иммуноглобулинов продолжается в течение всей жизни. Оно происходит в процессе дифференцировки B-лимфоцитов и является запрограммированно случайным. В его основе лежат сразу несколько механизмов, свойственных только генам антигенсвязывающих молекул (иммуноглобулин, TCR): рекомбинация зародышевых сегментов, неточность связей между V-, D- и J-сегментами, соматический гипермутагенез, комбинаторика тяжёлых и лёгких цепей в случае В-лимфоцитов или разных цепей TCR. Характеристика V-генов антигенраспознающих структур человека представлена на рис. 5-4.
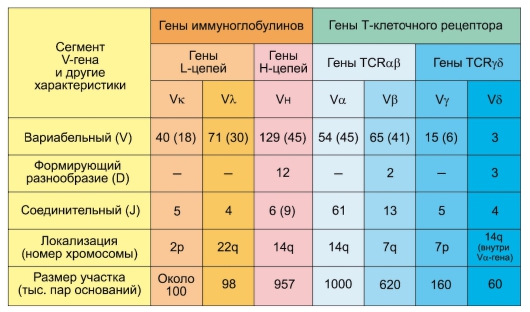
Рис. 5-4. Характеристика V-генов антигенраспознающих структур человека. Представлены основные характеристики семи известных типов вариабельных генов, определяющих формирование антигенраспознающих структур лимфоцитов. В строке «Вариабельный (V)» указано число зародышевых V-генов соответствующих типов; в скобках отмечено число функционирующих генов (остальные – псевдогены). В соответствующих строках выделено число сегментов D (где они есть) и J, участвующих в формировании зрелого V-гена. Указан размер участка на соответствующих хромосомах, занимаемый сегментами, из которых в процессе реаранжировки формируется зрелый V-ген
• Соматическая рекомбинация. На самом раннем этапе дифференцировки лимфоцитов начинается сложный генетический процесс объединения сегментов ДНК, кодирующих разные части антигенсвязывающих молекул – V- и C-домены. В непрерывную последовательность ДНК соединяются по одному сегменту из V-, D- и J-областей, при этом в каждом отдельном B-лимфоците возникает уникальная комбинация VDJ для тяжёлой цепи и VJ – для лёгкой. ДНК из промежутков, содержащих незадействованные зародышевые гены, выбрасывается из генома в виде кольцевых структур.
– Число возможных комбинаций можно подсчитать. Для к-цепи из 35 V-сегментов и 5 J-сегментов может получиться 35×5=175 вариантов V-области; для λ-цепи – 32×4=128 вариантов; всего для лёгких цепей 303 варианта; для тяжёлой цепи 45Vx23Dx6J=6210 вариантов антигенсвязывающих областей. В целой молекуле иммуноглобулина разные лёгкие и тяжёлые цепи объединяются в тетрамер также случайным образом (по крайней мере, теоретически). Число случайных сочетаний из 303 и 6210 – около 1,9×106.
– Рекомбиназы. Рекомбинацию ДНК генов иммуноглобулинов катализируют специальные ферменты – рекомбиназы RAG-1 и RAG-2 (Recombinase Activation Gene – активирующий рекомбинацию ген). Они же катализируют рекомбинацию ДНК генов TCR в T-лимфоцитах, т.е. рекомбиназы – уникальные ферменты лимфоцитов. Однако в B-лимфоцитах эти ферменты не «трогают» гены TCR, а в T-лимфоцитах «обходят» гены иммуноглобулинов. Следовательно, до начала процесса перестройки ДНК в клетке уже существуют регуляторные белки, различные у T- и B-лимфоцитов.
Рекомбинационный комплекс представлен на рис. 5-5.
Сигналом к перестройке V-генов антигенраспознающих рецепторов В- и Т-клеток служит экспрессия генов рекомбинационного комплекса, обеспечивающего основные события на уровне перестраиваемых V-генов и прилегающих генетических сегментов. Комплекс включает ферменты, катализирующие одно- и двунитевые разрывы ДНК, их сшивание, нематричную достройку свободных концов нитей ДНК, а также белки, способствующие сближению пространственно разъединённых фрагментов ДНК. Включение экспрессии генов рекомбинационного комплекса обусловлено действием дифференцировочных факторов.

Рис. 5-5. Рекомбинационный комплекс
Процесс реаранжировки начинается с экспрессии рекомбиназ RAG-1 и RAG-2. Рекомбиназы присоединяются рядом с сегментами, которым предстоит войти в состав зрелого V-гена. Затем они димеризуются, что приводит к формированию петли. После этого происходят разрывы двунитевой ДНК между сайтом связывания фермента и соответствующим сегментом. Свободные концы нитей сшиваются при участии ДНК-лигазы IV с образованием шпильки. Затем под влиянием эндонуклеазы Artemis происходит повторный разрыв нити ДНК в шпильке и попарное воссоединение (лигирование) нитей двуспиральной ДНК как в сегментах, которые войдут в состав зрелого V-гена (информационная последовательность), так и в удаляемом участке (сигнальная последовательность). Это становится возможным благодаря «подтягиванию» друг к другу ранее разъединённых участков ДНК, которое происходит с участием димера Ku70/Ku86 (Ku86 также называют Ku80). Этот процесс («разрешение» шпильки) происходит с участием ДНК-зависимой протеинкиназы DNA-PKcs. В результате формируется зрелый V-ген и сигнальное кольцо (рис. 5-6, 5-7).
Реаранжировка V-генов антигенраспознающих структур сопровождается сближением генетических сегментов. Этот процесс обеспечивается определённой организацией пространства между V-генами и
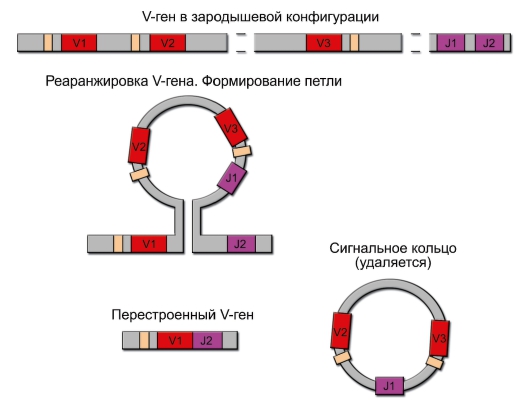
Рис. 5-6. Роль рекомбиназ RAG-1 и RAG-2 в начальных событиях перестройки V-генов
генетическими сегментами (J, D). Справа (с З’-конца) ко всем V-генам примыкают три участка ДНК со строго детерминированной последовательностью: гептамер (состава 5’CACAGTG3′), спейсер, состоящий из 23 пар оснований, и нонамер (состава 5’ACAAAAACC3′). К J-сегменту слева (с 5′-конца) примыкает гептамер, далее (влево) следует спейсер, содержащий 12 пар оснований, и нонамер. В случае генов, кодирующих Н- и λ-цепи, к гептамеру при V-гене примыкает спейсер, содержащий 23 пары оснований, а к гептамеру соединительных сегментов (J в случае λ-цепи, D в случае Н-цепи) – спейсер, содержащий 12 пар оснований. Для гена к-цепи характерно противоположное расположение 23- и 12-членных спейсеров, отражающих последовательности сегментов: для к-цепи – 7-12-9 – 9-23-7, для λ-цепи – 7-23-9 – 9-12-7. В случае генов Н-цепи ситуация усложняется наличием трёх генов/сегментов, подлежащих соединению (V-D-J). В этом случае цифровое правило принимает вид: 7-23-9 – 9-12-7 – 7-12-9 – 9-23-7. На
рис. 5-6 воспроизведена перестройка гена λ-цепи. При формировании петли гептамеры, прилегающие к V-гену и соединительным сегментам, узнают друг друга и взаимодействуют по принципу комплементарности, поскольку они представляют палиндромы, т.е. последовательности, читаемые от З’-конца и от 5′-конца, комплементарные друг другу, например CACAGTG и GTGACAC. То же можно сказать и о нонамерах. В результате такого взаимодействия сегменты, которые не войдут в состав зрелого V-гена, включаются в петлю и удаляются в составе сигнального кольца, а избранные V- и J-сегменты оказываются сближенными и образуют зрелый V-ген.
• Неточность связи V-D-J. Под неточностью связей сегментов V, D и J понимают тот факт, что при их формировании происходит добавление лишних нуклеотидов. Выделяют 2 типа таких нуклеотидов: P- и N-нуклеотиды.
– Нуклеотиды P (от англ. Palindromic sequences – зеркальные последовательности) возникают на концах каждого из сегментов, вовлечённых в рекомбинацию, при вырезании одноцепочечных
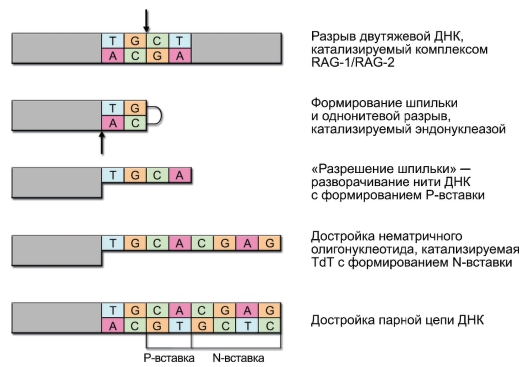
Рис. 5-7. Образование P- и N-вставок при реаранжировке V-генов
петель ДНК (шпилек) и «достройке хвостов» ферментами репарации ДНК.
– Нуклеотиды N (от англ. Nontemplate-encoded – нематрично кодируемые), характерны только для тяжёлых цепей, случайным образом пристраиваются к концам V-, D- и J-сегментов специальным ферментом – терминальной дезоксинуклеотидилтрансферазой (TdT).
– С учётом присоединения N- и P-нуклеотидов число вариантов антигенсвязывающих областей целых молекул иммуноглобулинов составляет порядка 1013. Если учесть аллельные варианты V-, D- и J-сегментов, то теоретически разнообразие составит около 1016 (в действительности это значение меньше, поскольку в организме нет такого числа лимфоцитов).
– В 2/3 случаев «платой» за попытки увеличить разнообразие антигенсвязывающих областей антител служит непродуктивная рекомбинация генов, т.е. сдвиг рамки считывания или генерация стоп-кодонов, делающие невозможной трансляцию белка.
• Гипермутагенез – запланированное повышение частоты точечных мутаций – отличает гены иммуноглобулинов даже от генов TCR. Гипермутагенез происходит только в В-лимфоцитах во время иммуногенеза (т.е. после состоявшегося распознавания антигена и начавшегося иммунного ответа) в зародышевых центрах лимфоидных фолликулов периферических лимфоидных органов и тканей (лимфатических узлов, селёзенки, диффузных скоплений). Частота точечных мутаций в V-генах иммуноглобулинов достигает 1-го нуклеотида из 1000 на 1 митоз (т.е. каждый второй В-лимфоцит клона в зародышевом центре приобретает точечную мутацию в V-гене иммуноглобулинов), тогда как для всей остальной ДНК она на 9 порядков ниже.
Гены константных доменов
Структурные гены константных доменов полипептидных цепей иммуноглобулинов расположены в тех же хромосомах, что и V-, D- и J-гены, к 3′-концу от J-сегментов.
• Лёгкая цепь (рис. 5-8). Для лёгких к-цепей существует один C-ген – Ск, а для λ-цепей (на рисунке не показаны) – 4 или 5 (в зависимости от гаплотипа) – Сλ1,2,3,6,7. «Стыковка» нуклеотидного кода для V- и C-доменов лёгких цепей происходит на уровне не ДНК, а РНК – по механизму сплайсинга первичного транскрипта РНК.
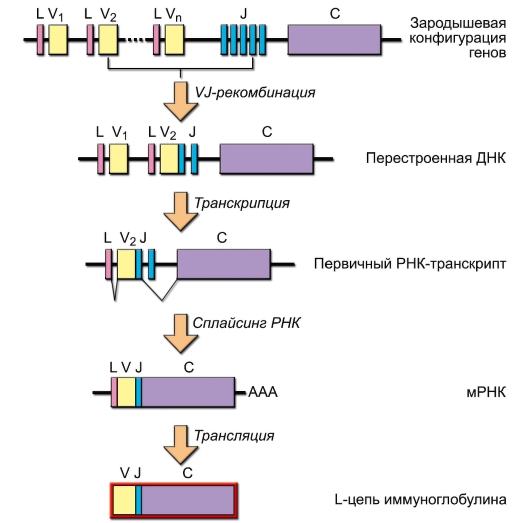
Рис. 5-8. Структура генов и синтез белка κ-лёгкой (L) цепи иммуноглобулинов человека
• Тяжёлая цепь (рис. 5-9) каждого изотипа иммуноглобулинов также кодируется отдельным C-геном. У человека такие гены расположены в следующем порядке, считая от J-сегмента к З’-концу: Сμ, Сδ, СγЗ, Сγ1, ψСε (псевдоген ε-цепи), Cα1, Cγ2, Cγ4, Сε, Сα2. Завершившие лимфопоэз B-лимфоциты, независимо от специфичности их BCR, экспрессируют иммуноглобулины только классов IgM и IgD. При этом мРНК транскрибируется в виде непрерывного первич-
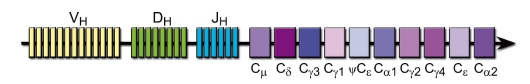
Рис. 5-9. Структура генов тяжёлой (Н) цепи иммуноглобулинов человека
ного транскрипта с перестроенных генов VDJ и Сμ/Cδ. ДНК C-генов других изотипов остаётся нетронутой. В результате альтернативного сплайсинга первичного транскрипта образуются мРНК отдельно для тяжёлых цепей IgM и IgD, которые и транслируются в белок. Этим процессом заканчивается полноценный лимфопоэз B-клеток.
Переключение изотипов иммуноглобулинов
В процессе развития иммунного ответа, т.е. после распознавания антигена и под действием определённых цитокинов и молекул клеточной мембраны T-лимфоцитов, может происходить переключение синтеза иммуноглобулинов на другие изотипы – IgG, IgE, IgA (рис. 5-10).
• Переключение изотипа тяжёлой цепи тоже идёт по механизму рекомбинации ДНК: к ранее перестроенной комбинации VDJ присоединяется один из C-генов тяжёлой цепи (либо Сγ1, либо Сγ2, либо Сγ3, либо Сγ4, либо Сε, либо Сα1, либо Сα2). При этом происходит разрыв ДНК по областям переключения – SR (Switch Region), расположенным в интронах перед каждым C-геном (за исключением Сδ).
• ДНК C-генов, предшествующих задействованному (расположенных на 5′-конце от него), элиминируется в виде кольцевых структур, поэтому дальнейшее переключение изотипа возможно только по направлению к 3′-концу.
• Установлено, что гипермутагенез и переключение изотипов иммуноглобулинов катализируются ферментом AID (Activation Induced Cytidine Deaminase – цитидиндезаминаза, индуцируемая активацией). Этот фермент специфически атакует экспрессированные гены иммуноглобулинов и отщепляет аминогруппы от цитидиновых оснований, которыми богата ДНК этих генов. В результате этого цитозины преобразуются в урацилы, которые распознаются и вырезаются ферментами репарации ДНК. Последующая цепочка каталитических реакций с участием более чем десяти различных белков (эндонуклеаз, фосфатаз, полимераз, гистонов и т.п.) приво-
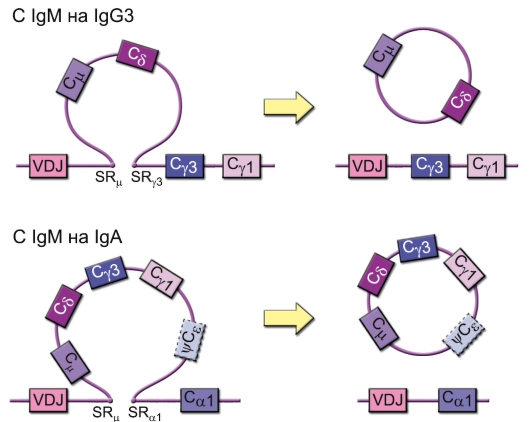
Рис. 5-10. Рекомбинация ДНК при переключении изотипов иммуноглобулинов B-лимфоцитов
дит к появлению мутаций (в случае гипермутагенеза) или двуцепочечных разрывов ДНК по областям переключения изотипов.
B-ЛИМФОЦИТЫ
В-клеточный рецептор (BCR)
Молекула иммуноглобулина способна связывать антиген как в растворе, так и в иммобилизованном на клетке состоянии, однако для формирования полноценного антигенраспознающего рецептора (BCR) необходимы ещё 2 полипептида, называемые Igα (CD79a) и Igβ (CD79b). Все 6 полипептидных цепей BCR представлены на рис. 5-11.
Внеклеточный домен. Igα и Igβ имеют по одному внеклеточному домену, которым они прочно, но нековалентно связаны с тяжёлыми цепями иммуноглобулинового компонента BCR.
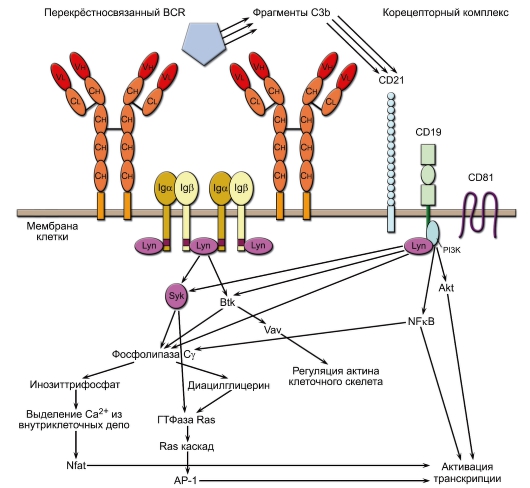
Рис. 5-11. Схема строения В-клеточного рецептора и связанных с ним молекул
Цитоплазматические активирующие последовательности. В цитоплазматических участках Igα и Igβ присутствуют характерные последовательности аминокислотных остатков, называемые иммунорецепторными тирозинсодержащими активирующими последовательностями (ITAM – Immunoreceptor Tyrosine-based Activation Motif); такие же последовательности присутствуют в проводящих сигнал компонентах антигенраспознающего рецептора T-клеток.
Активация B-лимфоцита. Пролиферацияидифференцировка В-лимфоцита может запускаться непосредственно связыванием антигена с BCR. Однако для эффективной активации только через BCR необходима
перекрёстная «сшивка» антигеном нескольких BCR. Для этого молекула антигена должна иметь повторяющиеся эпитопы на своей поверхности. В большинстве же случаев для активации В-клетки недостаточно сигнала, поступающего только от BCR, – требуется так называемый второй сигнал, поставляемый активированным Т-хелпером через корецепторы.
Корецепторный комплекс
В дополнительный корецепторный комплекс мембранных молекул, связанных с внутриклеточными системами проведения сигналов, входят, по крайней мере, 3 мембранные молекулы: CD19, CR2 (CD21) и TAPA-1 (CD81).
• CR2 – рецептор для компонентов комплемента. Связывание CR2 с продуктами деградации компонентов комплемента (C3b, C3dg и C3bi), опсонизировавших антиген, вызывает фосфорилирование молекулы CD19, которая в активированном состоянии ассоциирована с Src киназой Lyn.
• CD19. Фосфорилированная молекула CD19 активирует фосфатидилинозит-3-киназу (PI3K) и молекулу Vav (многофункциональная молекула проведения внутриклеточных сигналов), которые усиливают активационные реакции, инициированные BCR (см. рис. 5-11).
• TAPA-1 (Target of Antiproliferative Antibody – мишень для антипролиферативных антител) принадлежит к семейству тетраспанинов и в мембране физически примыкает к CD19 и CR2, однако детально роль этой молекулы еще не изучена.
Активация BCR запускает целый ряд каскадов, потенциирование которых зависит от получения дополнительных сигналов с рецепторов цитокинов, TLR и др. Первым шагом является активация тирозин-киназ Lyn, Fyn и Blk (принадлежат к семейству Src-киназ, Fyn и Blk на рисунке не показаны, поскольку они дублируют функции Lyn), а также тирозинкиназ Syk и Btk.
Дальнейшие события проведения сигнала с BCR показаны на рис. 5-11. Сигнальные каскады, идущие от антигенраспознающих рецепторов, более подробно описаны в главе 6 на примере TCR.
Дифференцировка B-лимфоцитов
Дифференцировка B-лимфоцитов из общей лимфоидной клеткипредшественника (потомка СКК) включает несколько этапов и процес-
сов: перестройку генов иммуноглобулинов и интеграцию их продуктов в клеточный метаболизм; экспрессию генов молекул, обеспечивающих проведение сигнала с BCR внутрь клетки; экспрессию генов мембранных молекул, необходимых для взаимодействия с другими клетками (в первую очередь с T-лимфоцитами и ФДК); экспрессию на мембране корецепторных комплексов.
Выделяют 3 главные субпопуляции В-лимфоцитов – В1-, В2(именно эти клетки мы привыкли называть собственно В-лимфоцитами) и В-клетки маргинальной зоны (Marginal Zone B, сокращенно MZB) (рис. 5-12). В1-клетки разделяют на подклассы В1а (CD5+) и B1b (CD5-), сходные по своим свойствам. На рис. 5-13 указаны дифференцировочные факторы, контролирующие развитие субпопуляций В-клеток, и приведены их основные отличительные свойства. В1-клетки и В-клетки маргинальной зоны участвуют в формировании первой линии иммун-
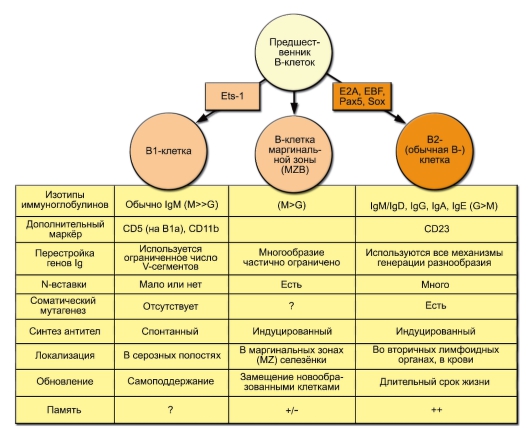
Рис. 5-12. Субпопуляции В-лимфоцитов
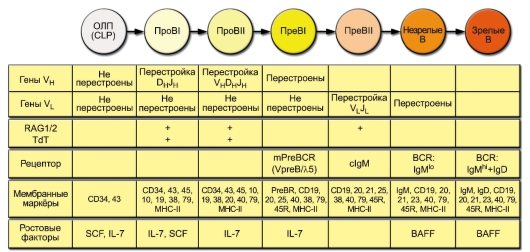
Рис. 5-13. Развитие В-лимфоцитов. Обозначения: DHJH, VHDHJH – стадии перестройки VH-гена BCR; VLJL – перестройка VL-гена BCR
ной защиты и служат переходным звеном от врождённого к адаптивному иммунитету. В2-клетки относятся к подсистеме адаптивного иммунитета, являясь основными клетками гуморального иммунного ответа.
B2-лимфоциты
Этапы В2-лимфопоэза. В зависимости от состояния V-генов иммуноглобулинов и варианта экспрессии антигенраспознающего рецептора BCR выделяют несколько стадий дифференцировки В-клеток. На схеме отражены изменения наиболее важных ядерных и мембранных молекул в процессе созревания В-лимфоцитов, а также ростовые факторы, определяющие их пролиферацию. Данные получены при изучении В2лимфоцитов, однако в основных чертах они справедливы также для В1и MZВ-клеток.
В лимфопоэзе B2-лимфоцитов выделяют 6 этапов: общая лимфоидная клетка-предшественник→ранняя про-B-клетка→поздняя проB-клетка → большая пре-B-клетка → малая пре-B-клетка → незрелая B-клетка → зрелая наивная B-клетка (выходит из костного мозга). • Общая лимфоидная клетка-предшественник (ОЛП или CLP – common lymphoid progenitor). Экспрессирует несколько молекул адгезии, обеспечивающих её удержание в течение необходимого периода времени в костном мозге, среди них VLA-4 (Very Late Activation Antigen-4 – очень поздний активационный антиген 4), лигандом
которого на клетках стромы служит VCAM-1 (Vascular Cell Adhesion Molecule – молекула адгезии к стенке сосуда).
• Ранняя про-B-клетка (ПроBI, см. рис. 5-13). Происходит D-Jрекомбинация в генах тяжёлых цепей, на обеих гомологичных хромосомах. В этой стадии, помимо молекул адгезии, экспрессируется рецептор c-Kit (CD117) для первого фактора роста – мембранной молекулы клеток стромы SCF (Stem Cell Factor) – фактора стволовых клеток. Это взаимодействие обеспечивает прохождение предшественниками B-лимфоцитов, ещё не поделёнными на клоны по антигенраспознающим рецепторам, необходимого числа митозов.
• Поздняя про-B-клетка (ПроВII, см. рис. 5-13). Происходит V-DJрекомбинация генов иммуноглобулинов. Сначала этот процесс затрагивает одну из гомологичных хромосом. Если она окажется непродуктивной, то рекомбинация повторяется на второй гомологичной хромосоме. Если перестройка на первой хромосоме продуктивна, вторая хромосома использована не будет. При этом происходит так называемое аллельное исключение (allelic exclusion), когда белок иммуноглобулина будет кодироваться только одной хромосомой, а вторая будет «молчащей». В результате индивидуальный лимфоцит сможет продуцировать антитела только одной специфичности. Этот процесс закладывает основу клональности антител.
– Как только в клетке происходит трансляция полипептида тяжёлой цепи, он экспрессируется на мембране в составе так называемого пре-B-рецептора. Этот рецептор содержит суррогатную лёгкую цепь (идентичную для всех клеток на этой стадии созревания), μ-цепь, Igα, Igβ. Экспрессия этого рецептора транзиторна, но абсолютно необходима для правильной дифференцировки B-лимфоцитов.
– Поздняя про-B-клетка также экспрессирует рецепторы для цитокинов ИЛ-7 и SDF-1, секретируемых клетками стромы и вызывающих пролиферацию и накопление «полуклонов» B-лимфоцитов (про-B- и больших пре-B-клеток) с уже известной специфичностью по тяжёлой цепи, но ещё неизвестной – по лёгкой. Это тоже увеличивает разнообразие молекул иммуноглобулинов: с одной и той же тяжёлой цепью будет сочетаться больше разных вариантов лёгких цепей.
• Пре-B-клетка. Выделяют две популяции пре-В клеток: Пре ВI (или большая пре-В) и ПреВII (или малая пре-В). На этой стадии про-
исходит V-J-перестройка генов иммуноглобулинов лёгких цепей (сначала одной из цепей – κ или λ) на одной из гомологичных хромосом. Если продуктивная перестройка с первой попытки не получается, предпринимаются следующие. Клетки, в которых не произошло ни одной продуктивной перестройки в генах тяжёлых и лёгких цепей, погибают по механизму апоптоза – явления, весьма распространённого среди лимфоцитов (подробнее в главе 9).
• Незрелый B-лимфоцит. Уже экспрессируется дефинитивный BCR, содержащий L-цепь, μ-цепь, а также Igα и Igβ.
Развитие толерантности. На стадии незрелых B-лимфоцитов начинается также развитие толерантности к собственным тканям организма. Для этого предусмотрено 3 механизма: делеция аутореактивных клонов, ареактивность (анергия) и «редактирование» рецептора по антигенной специфичности. Первые два механизма продолжают действовать и по выходе лимфоцита из костного мозга, т.е. при контакте со значительными количествами аутоантигенов.
• Негативная селекция и делеция клонов. Связывание мембранного антигена незрелой B-клеткой (экспрессирует IgM-BCR, но ещё отсутствует IgD-BCR) служит сигналом для её апоптоза. Таким образом, удаляются B-лимфоциты, несущие антигенраспознающие рецепторы, способные связывать белки собственных тканей.
• Ареактивность. Связывание незрелым B-лимфоцитом растворимого антигена не приводит к апоптозу, но лимфоцит приходит в состояние анергии, т.е. проведение сигнала от BCR блокируется и лимфоцит не активируется.
• «Редактирование» рецепторов происходит в небольшой части незрелых B-клеток, в которых ещё активны рекомбиназы RAG-1 и RAG-2. В этих клетках связывание IgM (в составе BCR на поверхности незрелого B-лимфоцита) с антигеном служит сигналом для запуска повторного процесса рекомбинации VDJ/VJ: образующаяся при этом новая комбинация может не быть аутореактивной.
Маркёр завершения B-лимфопоэза (образования зрелого наивного B-лимфоцита, готового к выходу из костного мозга в периферическую лимфоидную ткань) – одновременная экспрессия (коэкспрессия) на мембране двух типов BCR – IgM и IgD (причём IgD больше, чем IgM).
Иммуногенез. После распознавания антигена и вступления в иммунный ответ B-лимфоцит проходит в фолликулах периферических лимфоидных органов и тканей ещё 2 стадии додифференцировки, называемые иммуногенезом.
• Пролиферация центробластов. В зародышевых центрах фолликуллов B-лимфоциты, называемые на этой стадии центробластами, интенсивно пролиферируют, удерживаясь связями со специальными клетками стромы – ФДК.
– На ФДК экспрессированы необычные рецепторы для иммуноглобулинов (FcR), способные продолжительное время (дни, месяцы, возможно, годы) удерживать комплекс антиген-антитело на мембране клетки.
– В зародышевых центрах происходит возрастание аффинности антител в отношении специфичного антигена по механизму гипермутагенеза, так как на этом этапе дифференцировки выживают те из вновь мутировавших B-лимфоцитов, у которых аффинность BCR к антигенам на поверхности ФДК выше. Этот процесс также называют положительной селекцией.
• Выбор дальнейшего пути. На второй стадии иммуногенеза происходит выбор: B-лимфоцит становится либо B-лимфоцитом памяти (дифференцированный резерв на случай повторной встречи с тем же антигеном), либо плазматической клеткой (через промежуточную стадию плазмабласта) – секретирующую большие количества антител заданной специфичности (рис. 5-14).
B1-лимфоциты
Последующая информация будет касаться В1-лимфоцитов мышей. Совершенно очевидно, что у человека присутствуют клетки с функциональными характеристиками В1-лимфоцитов, но четкое разграничение этой популяции на основании поверхностных маркёров пока не сделано.
• B1-лимфоциты подразделяют на 2 субпопуляции: B1a (CD5+) и B1b (CD5–).
• Предшественники B1a-лимфоцитов ещё в эмбриональном периоде мигрируют из эмбриональных кроветворных тканей (фетальной печени, оментума) в брюшную и плевральную полости, где существуют как самоподдерживающаяся популяция, хотя небольшое восполнение из костного мозга всё же присутствует. В1b-лимфоциты тоже происходят из фетальных предшественников, однако их пул у взрослых может существенно пополняться за счёт костного мозга. Помимо полостей, В1-лимфоциты также присутствуют в небольших количествах в селезёнке и лимфатических узлах.
• Предназначение B1-лимфоцитов – быстрый ответ на проникающие в организм широко распространённые патогены (преимуще-
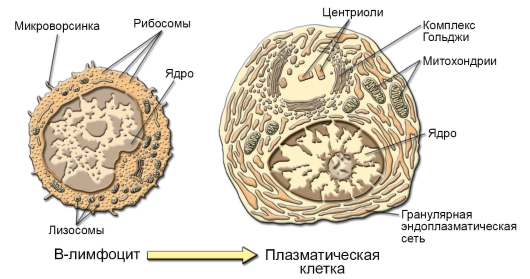
Рис. 5-14. B-лимфоцит и плазматическая клетка.Активированные B-лимфоциты, т.е. распознавшие антигенную детерминанту и получившие активационный сигнал, пролиферируют и заканчивают дифференцировку. Совокупность окончательно дифференцированных потомков B-лимфоцита составляет клон плазматических клеток, синтезирующих антитела (иммуноглобулины) именно к этой и только к этой антигенной детерминанте. Обратите внимание, что в цитоплазме плазматической клетки представлен сильно развитый белоксинтезирующий аппарат – гранулярная эндоплазматическая сеть. На мембране плазматических клеток уже нет ни иммуноглобулинов, ни MHC-II. В этих клетках прекращается переключение классов иммуноглобулинов и гипермутагенез, а дальнейший синтез антител уже не зависит от контакта с антигеном и взаимодействий с T-лимфоцитами
ственно бактерии). Почти все антитела В1-клеток принадлежат к IgM-изотипу и распознают наиболее распространённые соединения клеточных стенок бактерий. Преобладающая часть нормального IgM сыворотки крови здорового человека синтезируется именно B1-лимфоцитами. • Предполагают, что основная функция B1a-клеток – секреция естественных антител. Ещё до встречи с каким бы то ни было внешним антигеном в крови и биологических жидкостях организма уже присутствуют так называемые естественные (конститутивные) иммуноглобулины. У взрослых большинство из них относится к IgM, но есть также IgA и IgG. Эти антитела полиспецифичны и способны перекрестно связывать множество антигенов, включая аутоантиге-
ны. У мышей секреция естественных антител в основном происходит в селезёнке.
• Естественные антитела (их чаще называют «нормальные иммуноглобулины») выполняют ряд весьма важных для здоровья организма функций: «первая линия обороны» против патогенов; удаление из организма погибших клеток и продуктов катаболизма; презентация антигенов T-лимфоцитам; поддержание гомеостаза аутоиммунной реактивности (участвуют в поддержании толерантности к аутоантигенам, например, гистонам); противовоспалительное действие (нейтрализация суперантигенов, индукция синтеза противовоспалительных цитокинов, аттенуация комплементзависимого повреждения тканей и др.).
• Считается, что B1b-лимфоциты участвуют в продукции антител к Т-независимым антигенам, а также обеспечивают длительную иммунную память к некоторым микроорганизмам.
В-клетки маргинальной зоны
В-клетки маргинальной зоны (MZB) развиваются из костномозговых предшественников и находятся в маргинальных синусах селезёнки. Их основной задачей является ответ на Т-независимые антигены, находящиеся в крови. Поскольку для ответа на такие антигены не требуется сложной кооперации нескольких типов клеток, он развивается в кратчайшие сроки. MZB-клетки отличаются от В1а-лифоцитов по «происхождению», но функционально очень похожи. Обе эти популяции преимущественно экспрессируют антитела класса IgM, специфичные к полисахаридам и фосфолипидам (например, фосфорилхолину), расположенным на поверхности бактерий. Они также способны очень быстро дифференцироваться в плазматические клетки. Еще одной сходной чертой является почти полное отсутствие гипермутагенеза в генах, кодирующих экспрессируемые этими клетками иммуноглобулины.
Тимуснезависимые антигены
Некоторые антигены способны вызывать иммунный ответ с участием В-лимфоцитов, но без помощи T-лимфоцитов. Этот тип иммунного ответа характеризуется рядом особенностей: вырабатываются антитела только IgM-изотипа (обычно переключения изотипов нет, однако у мышей выявляют IgG3, специфичные к таким антигенам). При ответе на Т-независимые антигены иммунная память обычно не развивается, кроме того, не происходит «созревания» аффинности. Однако у подобного
ответа есть и преимущество: он развивается уже в первые двое суток после проникновения антигена и начинает защищать организм на ранних сроках инфекции, пока тимусзависимый ответ ещё не сформировался.
Антигены такого типа называют тимуснезависимыми и подразделяют на два класса.
• Тимуснезависимые антигены 1-го типа (ТН-1) в достаточно высоких концентрациях способны индуцировать поликлональную активацию B-лимфоцитов (зрелых и незрелых) и продукцию поликлональных иммуноглобулинов класса IgM. Эти вещества ещё называют B-клеточными митогенами. Бактериальный ЛПС – классический пример ТН-1-антигена. ЛПС связывается с BCR и в то же время активирует TLR4, запуская одновременно 2 сигнала, которые достаточны для поликлональной активации В-лимфоцитов.
• Тимуснезависимые антигены 2-го типа (ТН-2) представлены достаточно длинными молекулами с повторяющимися структурами (полисахариды бактериальных стенок, фиколл). Эти антигены мультивалентны и могут вызывать перекрёстную сшивку иммуноглобулиновых рецепторов. ТН-2, в отличие от ТН-1, способны активировать только зрелые B-лимфоциты – преимущественно B1. В незрелых B-клетках повторяющиеся антигенные эпитопы индуцируют анергию или апоптоз.
Взаимодействие Т-независимых антигенов с В-лимфоцитами проиллюстрировано на рис. 5-15.
Рис. 5-15. Разновидности Т-независимых антигенов
Иммунитет – особое биологическое свойство многоклеточных организмов, направленное на защиту от генетически чужеродных факторов: микроорганизмов (бактерий, вирусов, простейших, грибов), инородных молекул и др. Иммунитет также обеспечивает невосприимчивость организма к инфекции при повторной встрече с патогеном. В медицинском смысле этот термин употребляли ещё до нашей эры в значениях: неприкосновенный, чистый, не затронутый заболеванием, невредимый, находящийся под хорошей защитой, устойчивый к заразной болезни.
Совокупность органных, тканевых, клеточных и молекулярных компонентов, функцией которых является осуществление иммунной защиты, называется иммунной системой. Иммунология – наука о строении и функциях иммунной системы как в норме, так и при различных патологических состояниях, в том числе и при нарушениях самой иммунной системы – иммунопатологиях.
Иммунную защиту обеспечивают два механизма: врождённый и адаптивный.
Врождённый иммунитет является присущей каждому организму с рождения, генетически закреплённой способностью противостоять инфекции. Это передовая линия обороны организма против патогенов, пытающихся проникнуть или уже проникших в покровные ткани или внутреннюю среду. Врождённый иммунитет срабатывает мгновенно или в течение первых нескольких часов после контакта с патогеном (возбудители, выделяемые ими токсины и другие чужеродные молекулы). Он включает четыре основных уровня защиты: анатомический, физиологический, фагоцитарный и воспалительный – покровные ткани, фагоциты, микробоцидные гуморальные вещества (протеазы, сильные окислители и свободные радикалы, продуцируемые фагоцитами, эндогенные противомикробные пептиды и др.), сосудистые реакции. Первичные рецепторы врождённого иммунитета – это молекулы многоклеточных, позволяющие «считывать» эволюционную память – информацию о том, чем отличаются микроорганизмы от собственных клеток.
Эти рецепторы способны распознавать консервативные молекулярные структуры – РАМР (Pathogen-Associated Molecular Patterns), характерные для групп сходных микроорганизмов. В настоящее время постоянно открывают новые патогенраспознающие рецепторы врождённого иммунитета. К ним относят мембраносвязанные паттернраспознающие рецепторы (Pattern Recognition Receptors, PRR), а также растворимые рецепторы – ряд белков сыворотки крови: C-реактивный белок (СРБ), маннозосвязывающий лектин (MBL – Mannose-Binding Lectin), компоненты комплемента.
Собственные возможности клеток врождённого иммунитета санировать организм от проникшего патогена часто недостаточны. Множество патогенов приспособилось выживать в присутствии факторов врождённой резистентности к инфекциям. Именно поэтому в процессе эволюции, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный иммунитет – специфический. Материальные носители адаптивного иммунитета – лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток – способность распознавать почти неограниченное (1018) разнообразие молекулярных объектов – антигенов. Лимфоциты характеризуются экспрессией Т-клеточных (TCR) или В-клеточных (BCR) рецепторов, распознающих только одну антигенную детерминанту либо небольшое число структурно очень близких детерминант, и поэтому, в отличие от PRR, обладающих высокой специфичностью (рис. 1-1).
Адаптивный (приобретённый) иммунитет формируется в течение жизни индивидуума. Активно приобретённый иммунитет – состояние невосприимчивости к инфекции после перенесённого инфекционного заболевания или после вакцинации (сам организм вырабатывает соответствующие антитела). Пассивно приобретённый иммунитет – состояние невосприимчивости к инфекции в результате поступления в организм уже готовых антител от матери или в результате инъекции (сам организм эти антитела не вырабатывает).
ИММУННЫЙ ОТВЕТ
Врождённая и адаптивная системы защиты организма включают клеточный и гуморальный компоненты и активно взаимодействуют друг с другом в процессе иммунного ответа. Иммунный ответ – многоэтапный процесс, заключающийся в распознавании и деструкции патогена и повреждённых им тканей. В его основе лежит уникальное свойство иммун-

Рис. 1-1. Сравнение врождённого и адаптивного иммунитета
ной системы отличать «свое» («sef») от «чужого» («nonself») и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно – иммунные реакции. Распознавание множества чужеродных антигенов происходит благодаря наличию в организме огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов главного комплекса гистосовместимости (MHC) классов I и II. Нейтрализацию «чужого» осуществляют цирку-
лирующие в жидкостях организма антитела (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет).
Таким образом, основными характеристиками адаптивного иммунного ответа являются умение различать собственные антигены от чужеродных, специфичность и иммунная память.
• Различение «своего» и «чужого» выражается в дифференциации компонентов собственных тканей организма и чужеродных молекул. Специфическую неотвечаемость организма на собственные антигены обозначают как иммунную толерантность. Если же организм воспринимает собственные компоненты как чужеродные, развивается аутоиммунный ответ.
• Специфичность иммунного ответа проявляется в том, что иммунитет, сформировавшийся в результате контакта с определённым антигеном, будет обеспечивать защиту только против этого антигена.
• Иммунная память формируется в результате адаптивного иммунного ответа против конкретного возбудителя и сохраняется, как правило, в течение всей последующей жизни организма, защищая его от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к «запоминанию» антигенных детерминант патогена за счёт образования клеток иммунной памяти. Наличие иммунной памяти обусловливает развитие ускоренного и усиленного ответа (вторичный иммунный ответ) при повторном контакте с антигеном. Формирование иммунной памяти является основной целью вакцинации, т.е. процесса естественного или искусственного формирования иммунной защиты против определённой инфекции.
Схема развития иммунного ответа представлена на рис. 1-2. Содержание отдельных этапов иммунного ответа раскрыто ниже.
• Воспаление: участвуют клетки, поглощающие антигены (фагоциты, антигенпрезентирующие клетки) – в частности, дендритные клетки (ДК), макрофаги, эндотелиальные и другие клетки. Выделяются провоспалительные цитокины и хемокины.
• Переработка антигена (процессинг). После поглощения антигена антигенпрезентирующей клеткой (АПК) происходит его процессинг (расщепление и встраивание в молекулы MHC) и презентация на поверхности клетки. Это необходимо для распознавания антигена Т-лимфоцитами.
• Распознавание антигена происходит в периферических лимфоидных органах. Начало специфического иммунного ответа – про-

Рис. 1-2. Основные этапы иммунного ответа
лиферация и дифференцировка эффекторных и регуляторных лимфоцитов.
• Деструкция антигена и повреждённых патогеном тканей. При этом одни лимфоциты (помощники – хелперы) «нанимают» для выполнения эффекторных функций другие лимфоциты (эффекторные) и/или воспалительные лейкоциты (нейтрофилы, моноциты, базофилы, эозинофилы), тучные клетки, а также гуморальные литические системы типа комплемента.
• Выведение продуктов распада происходит с участием известных систем выделения.
КЛЕТКИ ИММУННОЙ СИСТЕМЫ
Клетки иммунной системы условно подразделяют на клетки врождённого и адаптивного иммунитета (рис. 1-3). Главным их различием является специфичность распознавания: низкая у первых и высокая у вторых. Существует и третья группа клеток – промежуточная, несущая черты обеих групп. Наличие этой группы показывает единство происхождения и способов защиты организма от чужеродных веществ антигенной природы.

Рис. 1-3. Клетки иммунной системы
В выполнении эффекторных иммунных функций очень важную роль играют АПК, T- и B-лимфоциты и NK-клетки (от англ. Natural Killer – естественный киллер, натуральный киллер).
• Антигенпрезентирующие клетки (АПК). К АПК относят макрофаги, дендритные клетки (включая клетки Лангерганса эпидермиса, М-клетки лимфатических фолликулов пищеварительного тракта и других слизистых оболочек, дендритные эпителиальные клетки тимуса), а также B-лимфоциты. АПК захватывают антиген, обрабатывают его (процессируют) и презентируют антигенные фрагменты на своей поверхности T-лимфоцитам (рис. 1-4).
• T-лимфоциты обусловливают клеточный иммунный ответ, а также помогают отвечать на антиген B-лимфоцитам при гуморальном иммунном ответе. Каждый T-лимфоцит несет на своей поверхности рецептор T-лимфоцитов (TCR – T-Cell Receptor) (см. рис. 5-1, в и рис. 6-1) строго одной специфичности, т.е. взаимодействующий с одним антигеном. T-клетки по экспрессии маркёрных антигенов CD (Cluster Differentiation) подразделяют на CD4+ и CD8+.
– CD4+ Т-лимфоциты (хелперы). Среди T-клеток, экспрессирующих мембранные маркёры CD4, выделяют Т-лимфоциты с эффекторными функциями (Th1, Th2, Th17) и Т-регуляторные клетки (естественные – Treg и индуцированные – Th3, или Tr1).

Рис. 1-4. Взаимодействие клеток в ходе гуморального иммунного ответа. Рецептор T-хелпера (TCR) распознаёт антигенную детерминанту (эпитоп), экспрессированную на поверхности антигенпрезентирующей клетки вместе с молекулой главного комплекса гистосовместимости класса II (MHC-II). Во взаимодействии участвует маркёрная молекула T-хелпера – CD4. В результате подобного взаимодействия антигенпрезентирующая клетка секретирует интерлейкин-1 (ИЛ-1), стимулирующий в T-хелпере синтез и секрецию цитокинов, включая ИЛ-2, а также синтез и перенос на плазматическую мембрану T-хелпера рецепторов для ИЛ-2 (ИЛ-2 также стимулирует пролиферацию T-хелперов). Отбор B-лимфоцитов происходит при взаимодействии антигена с вариабельными участками антител (иммуноглобулинов) на поверхности этих клеток (правая часть рисунка). Эпитоп этого антигена в комплексе с молекулой MHC-II распознаёт рецептор T-хелпера, после чего T-лимфоцит секретирует цитокины, стимулирующие пролиферацию B-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие антитела к данному антигену. Также показаны некоторые мембранные белки (CD40/CD40L и CD28/B7), участвующие в проведении костимуляторных сигналов, необходимых для полноценной активации взаимодействующих клеток (они описаны подробнее в главе 7)
◊ T-хелперы при взаимодействии с АПК специфически распознают антигены и начинают вырабатывать определённый набор цитокинов соответственно типу инфекционного агента: Th2 при взаимодействии с B-клетками индуцируют гуморальный иммунный ответ (см. рис. 1-4), а Th1 – при взаимодействии с макрофагами и цитотоксическими Т-лимфоцитами (ЦТЛ) – клеточный иммунный ответ. Th17 продуцируют ИЛ17 – мощный индуктор тканевого воспаления, привлекающий и активирующий гранулоциты и макрофаги.
◊ Регуляторные T-клетки (Т-регуляторы) контролируют интенсивность иммунного ответа, подавляя активность других субпопуляций Т-лимфоцитов.
– CD8+ Т-лимфоциты. Субпопуляция T-клеток, экспрессирующих мембранные молекулы CD8. Эти клетки выступают в роли ЦТЛ. Они лизируют клетки-мишени, несущие чужеродные или видоизменённые собственные антигены – аутоантигены: например, клетки опухоли, трансплантата, инфицированные вирусом клетки, несущие поверхностные вирусные антигены. Эффекторные функции ЦТЛ реализуются через индукцию образования в клетках-мишенях пор (под действием особых белков – перфоринов) и секрецию в поры специализированных сериновых протеаз – гранзимов. Вызванное этим нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки (рис. 1-5). Под влиянием гранзимов индуцируются процессы запрограммированной гибели клетки – апоптоза.
• Т-клетки памяти – долгоживущие рециркулирующие малые лимфоциты, формируемые при первичном иммунном ответе. Они «запоминают» особенности детерминант антигенов и при повторном распознавании того же антигена развивают быстрый и усиленный ответ. Т-клетки памяти отличаются от наивных и эффекторных Т-лимфоцитов высоким уровнем экспрессии мембранных маркёров активации, меньшей потребностью в провоспалительных медиаторах и корецепторных сигналах для развития вторичного иммунного ответа.
• B-лимфоциты отвечают за гуморальный иммунный ответ. На мембране B-лимфоцитов присутствует рецептор для антигена – мономер IgM. Продолжительность жизни большинства B-лимфоцитов (если они не активируются антигеном!) не превышает 10 сут.

Рис. 1-5. Уничтожение клетки-мишени цитотоксическим T-лимфоцитом (Т-киллером). При сближении цитотоксического T-лимфоцита с клеткоймишенью после специфичного взаимодействия мембранных молекул клетокпартнёров T-лимфоцит убивает клетку-мишень
– Эффекторные B-лимфоциты. Активированные B-лимфоциты размножаются и дифференцируются в плазматические клетки (см. рис. 5-9), вырабатывающие антитела (иммуноглобулины, специфичные к конкретному антигену). При этом плазматические клетки теряют экспрессию специфических рецепторов для антигена.
– B-лимфоциты иммунной памяти – долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об антигене, с которым когда-то контактировали, за счёт продолжающейся экспрессии рецептора для антигена. Клетки памяти активируются
при повторном распознавании того же антигена. В этом случае B-лимфоциты памяти, при обязательном участии T-хелперов и ряда других факторов, превращаются в плазматические клетки, обеспечивая быстрый синтез большого количества специфичных антител, взаимодействующих с чужеродным антигеном, и развитие эффективного иммунного ответа. • NK-клетки (от англ. Natural Killer – естественный киллер) – лимфоциты, лишённые характерных для T- и B-клеток поверхностных CD-маркёров, а также антигенраспознающих рецепторов – TCR (T Cell Receptor) или BCR (B Cell Receptor). Эти клетки играют важную роль в механизмах врождённого иммунитета (см. главу 3), уничтожают трансформированные, инфицированные вирусами и чужеродные клетки.
Иммунная система состоит из различных компонентов – органов, тканей и клеток, отнесённых к этой системе по функциональному критерию (выполнение иммунной защиты организма) и анатомофизиологическому принципу организации (органно-циркуляторный принцип). В иммунной системе выделяют: первичные органы (костный мозг и тимус), вторичные органы (селезёнка, лимфатические узлы, пейеровы бляшки и др.), а также диффузно расположенную лимфоидную ткань – отдельные лимфоидные фолликулы и их скопления. Особо выделяют лимфоидную ткань, ассоциированную со слизистыми оболочками (Mucosa-Associated Lymphoid Tussue – MALT).
Лимфоидная система – совокупность лимфоидных клеток и органов. Часто лимфоидную систему упоминают как анатомический эквивалент и синоним иммунной системы, однако это не вполне верно. Лимфоидная система является лишь частью иммунной системы: по лимфатическим сосудам клетки иммунной системы мигрируют к лимфоидным органам – месту индукции и формирования иммунного ответа. Кроме того, лимфоидную систему не следует путать с лимфатической – системой лимфатических сосудов, по которым происходит циркуляция лимфы в организме. Лимфоидная система тесно связана с кровеносной и эндокринной системами, а также с покровными тканями – слизистыми оболочками и кожей. Названные системы – основные партнёры, на которые в своей работе опирается иммунная система.
Органно-циркуляторный принцип организации иммунной системы. В организме взрослого здорового человека содержится около 1013 лимфоцитов, т.е. примерно каждая десятая клетка тела – лимфоцит. Анатомо-физиологически иммунная система организована по органноциркуляторному принципу. Это означает, что лимфоциты не являются строго резидентными клетками, а интенсивно рециркулируют между лимфоидными органами и нелимфоидными тканями через лимфатические сосуды и кровь. Так, через каждый лимфатический узел за 1 ч проходит ≈109 лимфоцитов. Миграцию лимфоцитов обусловливают
специфические взаимодействия конкретных молекул на мембранах лимфоцитов и клеток эндотелия стенки сосудов [такие молекулы называют адгезинами, селектинами, интегринами, хоминг-рецепторами (от англ. home – дом, место прописки лимфоцита)]. В результате каждый орган обладает характерным набором популяций лимфоцитов и их клеток-партнёров по иммунному ответу.
Состав иммунной системы. По типу организации выделяют различные органы и ткани иммунной системы (рис. 2-1).
• Кроветворный костный мозг – место локализации стволовых кроветворных клеток (СКК).

Рис. 2-1. Компоненты иммунной системы
• Инкапсулированные органы: тимус, селезёнка, лимфатические узлы.
• Неинкапсулированная лимфоидная ткань.
– Лимфоидная ткань слизистых оболочек (MALT – MucosalAssociated Lymphoid Tissue). Независимо от локализации содержит внутриэпителиальные лимфоциты слизистой оболочки, а также специализированные образования:
◊ лимфоидная ткань, ассоциированная с пищеварительным трактом (GALT – Gut-Associated Lymphoid Tissue). В ней выделяют миндалины, аппендикс, пейеровы бляшки, lamina propria («собственная пластинка») кишечника, отдельные лимфоидные фолликулы и их группы;
◊ лимфоидная ткань, ассоциированная с бронхами и бронхиолами (BALT – Bronchus-Associated Lymphoid Tissue);
◊лимфоидная ткань, ассоциированная с женскими половыми путями (VALT – Vulvovaginal-Associated Lymphoid Tissue);
◊лимфоидная ткань, ассоциированная с носоглоткой (NALT – Nose-Associated Lymphoid Tissue).
– Особое место в иммунной системе занимает печень. В ней присутствуют субпопуляции лимфоцитов и других клеток иммунной системы, «обслуживающие» в качестве лимфоидного барьера кровь воротной вены, несущей все всасываемые в кишечнике вещества.
– Лимфоидная подсистема кожи – лимфоидная ткань, ассоциированная с кожей (SALT – Skin-Associated Lymphoid Tissue) – диссеминированные внутриэпителиальные лимфоциты и региональные лимфатические узлы и сосуды лимфодренажа.
• Периферическая кровь – транспортно-коммуникационный компонент иммунной системы.
Центральные и периферические органы иммунной системы
• Центральные органы. Кроветворный костный мозг и тимус – центральные органы иммунной системы, именно в них начинается миелопоэз и лимфопоэз – дифференцировка моноцитов и лимфоцитов от СКК до зрелой клетки.
– До рождения плода развитие В-лимфоцитов происходит в фетальной печени. После рождения эта функция передаётся костному мозгу.
– В костном мозге проходят полные «курсы» эритропоэза (образование эритроцитов), миелопоэза (образование нейтрофилов,
моноцитов, эозинофилов, базофилов), мегакариоцитопоэза (формирование тромбоцитов), а также проходит дифференцировка ДК, NK-клеток и В-лимфоцитов. – Предшественники T-лимфоцитов для прохождения лимфопоэза мигрируют из костного мозга в тимус и слизистую оболочку пищеварительного тракта (внетимическое развитие).
• Периферические органы. В периферических лимфоидных органах (селезёнка, лимфатические узлы, неинкапсулированная лимфоидная ткань) зрелые наивные лимфоциты контактируют с антигеном и АПК. Если антигенраспознающий рецептор лимфоцита связывает комплементарный антиген в периферическом лимфоидном органе, то лимфоцит вступает на путь дальнейшей дифференцировки в режиме иммунного ответа, т.е. начинает пролиферировать и продуцировать эффекторные молекулы – цитокины, перфорин, гранзимы и др. Такую додифференцировку лимфоцитов на периферии называют иммуногенезом. В результате иммуногенеза формируются клоны эффекторных лимфоцитов, распознающих антиген и организующих деструкцию как его самого, так и периферических тканей организма, где этот антиген присутствует.
Клетки иммунной системы. В состав иммунной системы входят клетки различного происхождения – мезенхимного, экто- и энтодермального.
• Клетки мезенхимного генеза. К ним относят клетки, дифференцировавшиеся из предшественников лимфо/гематопоэза. Разновидности лимфоцитов – T, B и NK, которые в процессе иммунного ответа кооперируются с различными лейкоцитами – моноцитами/ макрофагами, нейтрофилами, эозинофилами, базофилами, а также ДК, тучными клетками и эндотелиоцитами сосудов. Даже эритроциты вносят свой вклад в реализацию иммунного ответа: транспортируют иммунные комплексы «антиген-антитело-комплемент» в печень и селёзенку для фагоцитоза и разрушения.
• Эпителий. В состав некоторых лимфоидных органов (тимус, некоторые неинкапсулированные лимфоидные ткани) входят эпителиальные клетки эктодермального и энтодермального происхождения.
Гуморальные факторы. Помимо клеток, «иммунная материя» представлена растворимыми молекулами – гуморальными факторами. Это продукты B-лимфоцитов – антитела (они же иммуноглобулины) и растворимые медиаторы межклеточных взаимодействий – цитокины.
ТИМУС
В тимусе (thymus) проходит лимфопоэз значительной части T-лимфоцитов («Т» происходит от слова «Thymus»). Тимус состоит из 2 долей, каждая из которых окружена капсулой из соединительной ткани. Перегородки, идущие от капсулы, разделяют тимус на дольки. В каждой дольке тимуса (рис. 2-2) выделяют 2 зоны: по периферии – корковая (cortex), в центре – мозговая (medulla). Объём органа заполнен эпителиальным каркасом (эпителий), в котором располагаются тимоциты (незрелые Т-лимфоциты тимуса), ДК и макрофаги. ДК расположены преимущественно в зоне, переходной между корковой и мозговой. Макрофаги присутствуют во всех зонах.
• Эпителиальные клетки своими отростками обхватывают лимфоциты тимуса (тимоциты), поэтому их называют «nurse cells» (клетки-«сиделки» или клетки-«няньки»). Эти клетки не только поддерживают развивающиеся тимоциты, но также продуцируют

Рис. 2-2. Строение дольки тимуса
цитокины ИЛ-1, ИЛ-3, ИЛ-6, ИЛ-7, LIF, GM-CSF и экспрессируют молекулы адгезии LFA-3 и ICAM-1, комплементарные молекулам адгезии на поверхности тимоцитов (CD2 и LFA-1). В мозговой зоне долек расположены плотные образования из скрученных эпителиальных клеток – тельца Гассаля (тельца тимуса) – места компактного скопления дегенерирующих эпителиальных клеток.
• Тимоциты дифференцируются из костномозговых СКК. Из тимоцитов в процессе дифференцировки образуются Т-лимфоциты, способные распознавать антигены в комплексе с MHC. Однако большинство Т-лимфоцитов либо не сможет обладать этим свойством, либо будет распознавать аутоантигены. Для предотвращения выхода таких клеток на периферию в тимусе инициируется их элиминация путем индукции апоптоза. Таким образом, в норме в циркуляцию из тимуса выходят только клетки, способные распознавать антигены в комплексе со «своими» MHC, но при этом не индуцирующие развитие аутоиммунных реакций.
• Гематотимический барьер. Тимус сильно васкуляризован. Стенки капилляров и венул образуют гематотимический барьер на входе в тимус и, возможно, на выходе из него. Зрелые лимфоциты выходят из тимуса либо свободно, так как каждая долька имеет эфферентный лимфатический сосуд, выносящий лимфу в лимфатические узлы средостения, либо путём экстравазации через стенку посткапиллярных венул с высоким эндотелием в корково-мозговой области и/или через стенку обычных кровеносных капилляров.
• Возрастные изменения. К моменту рождения тимус полностью сформирован. Он густо заселён тимоцитами в течение всего детства и до момента полового созревания. После пубертата тимус начинает уменьшаться в размерах. Тимэктомия у взрослых не приводит к серьёзным нарушениям иммунитета, поскольку в детстве и подростковом возрасте создаётся необходимый и достаточный пул периферических T-лимфоцитов на всю оставшуюся жизнь.
ЛИМФАТИЧЕСКИЕ УЗЛЫ
Лимфатические узлы (рис. 2-3) – множественные, симметрично расположенные, инкапсулированные периферические лимфоидные органы бобовидной формы, размером от 0,5 до 1,5 см в длину (при отсутствии воспаления). Лимфатические узлы через афферентные (приносящие) лимфатические сосуды (их несколько на каждый узел) дренируют тка-

Рис. 2-3. Строение лимфатического узла мыши: а – корковая и мозговая части. В корковой части расположены лимфатические фолликулы, от которых в мозговую часть отходят мозговые тяжи; б – распределение T- и B-лимфоцитов. Тимусзависимая зона выделена розовым цветом, тимуснезависимая зона – жёлтым. T-лимфоциты поступают в паренхиму узла из посткапиллярных венул и вступают в контакт с фолликулярными дендритными клетками и B-лимфоцитами
невую жидкость. Таким образом, лимфатические узлы – «таможня» для всех веществ, в том числе для антигенов. Из анатомических ворот узла вместе с артерией и веной выходит единственный эфферентный (выносящий) сосуд. В итоге лимфа попадает в грудной лимфатический проток. Паренхима лимфатического узла состоит из T-клеточной, B-клеточной зон и мозговых тяжей.
• B-клеточная зона. Корковое вещество разделено соединительнотканными трабекулами на радиальные секторы и содержит лимфоидные фолликулы, это B-лимфоцитарная зона. Строма фолликулов содержит фолликулярные дендритные клетки (ФДК), формирующие особое микроокружение, в котором происходит уникальный для B-лимфоцитов процесс соматического гипермутагенеза вариабельных сегментов генов иммуноглобулинов и отбор наиболее аффинных вариантов антител («созревание аффинности антител»). Лимфоидные фолликулы проходят 3 стадии развития. Первичный фолликул – мелкий фолликул, содержащий наивные B-лимфоциты. После того как B-лимфоциты вступают в иммуногенез, в лимфоидном фолликуле появляется герминативный (зародышевый) центр, содержащий интенсивно пролиферирующие B-клетки (это происходит примерно через 4-5 дней после активной иммунизации). Это вторичный фолликул. По завершении иммуногенеза лимфоидный фолликул существенно уменьшается в размере.
• T-клеточная зона. В паракортикальной (T-зависимой) зоне лимфатического узла расположены T-лимфоциты и интердигитальные ДК (они отличаются от ФДК) костномозгового происхождения, которые презентируют антигены T-лимфоцитам. Через стенку посткапиллярных венул с высоким эндотелием происходит миграция лимфоцитов из крови в лимфатический узел.
• Мозговые тяжи. Под паракортикальной зоной расположены содержащие макрофаги мозговые тяжи. При активном иммунном ответе в этих тяжах можно видеть множество зрелых B-лимфоцитов – плазматические клетки. Тяжи впадают в синус мозгового вещества, из которого выходит эфферентный лимфатический сосуд.
СЕЛЕЗЁНКА
Селезёнка – относительно большой непарный орган массой около 150 г. Лимфоидная ткань селезёнки – белая пульпа. Селезёнка – лимфоцитарная «таможня» для антигенов, попавших в кровь. Лимфоциты

Рис. 2-4. Селезёнка человека. Тимусзависимая и тимуснезависимая зоны селезёнки. Скопление T-лимфоцитов (зелёные клетки) вокруг артерий, вышедших из трабекул, образует тимусзависимую зону. Лимфатический фолликул и окружающая его лимфоидная ткань белой пульпы формируют тимуснезависимую зону. Так же как и в фолликулах лимфатических узлов, здесь присутствуют B-лимфоциты (жёлтые клетки) и фолликулярные дендритные клетки. Вторичный фолликул содержит герминативный центр с быстроделящимися В-лимфоцитами, окружёнными кольцом малых покоящихся лимфоцитов (мантией)
селезёнки накапливаются вокруг артериол в виде так называемых периартериолярных муфт (рис. 2-4).
T-зависимая зона муфты непосредственно окружает артериолу. B-клеточные фолликулы расположены ближе к краю муфты. Артериолы селезёнки впадают в синусоиды (это уже красная пульпа). Синусоиды заканчиваются венулами, собирающимися в селезёночную вену, несущую кровь в воротную вену печени. Красную и белую пульпу разделяет диффузная маргинальная зона, населенная особой популяцией В-лимфоцитов (В-клетки маргинальной зоны) и особыми макрофагами. Клетки маргинальной зоны являются важным связующим звеном между врождённым и приобретённым иммунитетом. Здесь происходит самый первый контакт организованной лимфоидной ткани с возможными патогенами, циркулирующими в крови.
ПЕЧЕНЬ
Печень выполняет важные иммунные функции, что вытекает из следующих фактов:
• печень – мощный орган лимфопоэза в эмбриональном периоде;
• аллогенные трансплантаты печени отторгаются менее интенсивно, чем другие органы;
• толерантность к вводимым перорально антигенам можно индуцировать только при нормальном физиологическом кровоснабжении печени и не удаётся индуцировать после операции по созданию портокавальных анастомозов;
• печень синтезирует белки острой фазы (СРБ, MBL и др.), а также белки системы комплемента;
• в печени содержатся разные субпопуляции лимфоцитов, в том числе уникальные лимфоциты, сочетающие признаки T- и NK-клеток (NKT-клетки).
Клеточный состав печени
Гепатоциты формируют паренхиму печени и содержат очень мало молекул MHC-I. Молекулы MHC-II гепатоциты в норме почти не несут, однако их экспрессия может возрастать при заболеваниях печени.
Клетки Купфера – макрофаги печени. Они составляют около 15% от общего числа клеток печени и 80% всех макрофагов организма. Плотность макрофагов выше в перипортальных областях.
Эндотелий синусоидов печени не имеет базальной мембраны – тонкой внеклеточной структуры, состоящей из разных типов коллагенов и других белков. Эндотелиальные клетки формируют монослой с просветами, через которые лимфоциты могут непосредственно контактировать с гепатоцитами. Кроме того, эндотелиальные клетки экпрессируют различные рецепторы-«мусорщики» (scavenger-рецепторы).
Лимфоидная система печени, кроме лимфоцитов, содержит анатомический отдел циркуляции лимфы – пространства Диссе. Эти пространства с одной стороны непосредственно контактируют с кровью синусоидов печени, а с другой – с гепатоцитами. Лимфоток в печени значителен – не менее 15-20% всего лимфотока организма.
Звёздчатые клетки (клетки Ито) расположены в пространствах Диссе. Они содержат жировые вакуоли с витамином А, а также характерные для гладкомышечных клеток α-актин и десмин. Звёздчатые клетки могут трансформироваться в миофибробласты.
ЛИМФОИДНАЯ ТКАНЬ СЛИЗИСТЫХ ОБОЛОЧЕК И КОЖИ
Неинкапсулированная лимфоидная ткань слизистых оболочек представлена глоточным лимфоидным кольцом Пирогова-Вальдейера, пейеровыми бляшками тонкой кишки, лимфоидными фолликулами аппендикса, лимфоидной тканью слизистых оболочек желудка, кишечника, бронхов и бронхиол, органов мочеполовой системы и других слизистых оболочек.
Пейеровы бляшки (рис. 2-5) – групповые лимфатические фолликулы, расположенные в lamina propria тонкой кишки. Фолликулы, точнее T-клетки фолликулов, примыкают к кишечному эпителию под так называемыми M-клетками («М» от Membranous, эти клетки не имеют микроворсинок), являющимися «входными воротами» пейеровой бляшки. Основная масса лимфоцитов расположена в B-клеточных фолликулах с зародышевыми центрами. T-клеточные зоны окружают фолликул ближе к эпителию. B-лимфоциты составляют 50-70%, T-лимфоциты – 10-30% всех клеток пейеровой бляшки. Основная функция пейеровых бляшек – поддержание иммуногенеза B-лимфоцитов и их дифференци-
Глава 3. МЕХАНИЗМЫ ВРОЖДЁННОГО ИММУНИТЕТА
Врождённый иммунитет – наиболее ранний защитный механизм как в эволюционном плане (он существует практически у всех многоклеточных), так и по времени ответа, развивающегося в первые часы и дни после проникновения чужеродного материала во внутреннюю среду, т.е. задолго до развития адаптивной иммунной реакции. Значительную часть патогенов инактивируют именно врождённые механизмы иммунитета, не доводя процесс до развития иммунного ответа с участием лимфоцитов. И только если механизмы врождённого иммунитета не справляются с проникающими в организм патогенами, в «игру» включаются лимфоциты. При этом адаптивный иммунный ответ невозможен без вовлечения механизмов врождённого иммунитета. Кроме того, врождённый иммунитет играет главную роль в удалении апоптотических и некротических клеток и реконструировании повреждённых органов. В механизмах врождённой защиты организма важнейшую роль играют первичные рецепторы для патогенов, система комплемента, фагоцитоз, эндогенные пептиды-антибиотики и факторы защиты от вирусов – интерфероны. Функции врождённого иммунитета схематично представлены на рис. 3-1.
РЕЦЕПТОРЫ РАСПОЗНАВАНИЯ «ЧУЖОГО»
На поверхности микроорганизмов присутствуют повторяющиеся молекулярные углеводные и липидные структуры, которые в подавляющем большинстве случаев отсутствуют на клетках организма хозяина. Особые рецепторы, распознающие этот «узор» на поверхности патогена, – PRR (Pattern Recognition Receptors – паттернраспознающие рецепторы) – позволяют клеткам врождённого иммунитета обнаруживать микробные клетки. В зависимости от локализации выделяют растворимые и мембранные формы PRR.
• Циркулирующие (растворимые) рецепторы для патогенов – белки сыворотки крови, синтезируемые печенью: липополисахаридсвя-

Рис. 3-1. Функции врождённого иммунитета. Обозначения: PAMP (PathogenAssociated Molecular Patterns) – молекулярные структуры микроорганизмов, HSP (Heat Shock Proteins) – белки теплового шока, TLR (Toll-Like Receptors), NLR (NOD-Like Receptors), RLR (RIG-Like Receptors) – клеточные рецепторы
зывающий белок (LBP – Lipopolysaccharide Binding Protein), компонент системы комплемента C1q и белки острой фазы MBL и С-реактивный белок (СРБ). Они непосредственно связывают микробные продукты в жидких средах организма и обеспечивают возможность их поглощения фагоцитами, т.е. являются опсонинами (от греч. opsonein – делающий вкусным). Кроме того, некоторые из них активируют систему комплемента.
– СРБ, связывая фосфорилхолин клеточных стенок ряда бактерий и одноклеточных грибов, опсонизирует их и активирует систему комплемента по классическому пути.
– MBL принадлежит к семейству коллектинов. Имея сродство к остаткам маннозы, экспонированным на поверхности многих микробных клеток, MBL запускает лектиновый путь активации комплемента.
– Белки сурфактанта лёгких – SP-A и SP-D принадлежат к тому же молекулярному семейству коллектинов, что и MBL. Они, вероятно, имеют значение в опсонизации (связывании антител с клеточной стенкой микроорганизма) лёгочного патогена – одноклеточного грибка Pneumocystis carinii.
• Мембранные рецепторы. Эти рецепторы расположены как на наружных, так и на внутренних мембранных структурах клеток.
– TLR (Toll-Like Receptor – Toll-подобный рецептор; т.е. сходный с Toll-рецептором дрозофилы). Одни из них непосредственно связывают продукты патогенов (рецепторы для маннозы макрофагов, TLR дендритных и других клеток), другие работают совместно с иными рецепторами: например, CD14 молекула на макрофагах связывает комплексы бактериального липополисахарида (ЛПС) с LBP, а TLR-4 вступает во взаимодействие с CD14 и передаёт соответствующий сигнал внутрь клетки. Всего у млекопитающих описано 13 различных вариантов TLR (у человека пока только 10).
• Цитоплазматические рецепторы:
– NOD-рецепторы (NOD1 и NOD2) находятся в цитозоле и состоят из трёх доменов: N-концевого CARD-домена, центрального NOD-домена (NOD – Nucleotide Oligomerization Domain – домен олигомеризации нуклеотидов) и C-концевого LRR-домена. Различие между этими рецепторами заключается в количестве CARD-доменов. Рецепторы NOD1 и NOD2 распознают мурамилпептиды – вещества, образующиеся после ферментативного гидролиза пептидогликана, входящего в состав клеточной стенки всех бактерий. NOD1 распознаёт мурамилпептиды с концевой мезодиаминопимелиновой кислотой (meso-DAP), которые образуются только из пептидогликана грамотрицательных бактерий. NOD2 распознаёт мурамилдипептиды (мурамилдипептид и гликозилированный мурамилдипептид) с концевым D-изоглутамином или D-глутаминовой кислотой, являющиеся результатом гидролиза пептидогликана как грамположительных, так и грамотрицательных бактерий. Кроме того, NOD2 имеет сродство к мурамилпептидам с концевым L-лизином, которые есть только у грамположительных бактерий.
– RIG-подобные рецепторы (RLR, RIG-Like Receptors): RIG-I (Retinoic acid-Inducible Gene I), MDA5 (Melanoma Differentiation-associated Antigen 5) и LGP2 (Laboratory of Genetics and Physiology 2).
Все три рецептора, кодируемые этими генами, имеют сходную химическую структуру и локализуются в цитозоле. Рецепторы RIG-I и MDA5 распознают вирусную РНК. Роль белка LGP2 пока неясна; возможно, он выполняет роль хеликазы, связываясь с двуцепочечной вирусной РНК, модифицирует её, что облегчает последующее распознавание с помощью RIG-I. RIG-I распознаёт односпиральную РНК с 5-трифосфатом, а также относительно короткие (<2000 пар оснований) двуспиральные РНК. MDA5 различает длинные (>2000 пар оснований) двуспиральные РНК. Таких структур в цитоплазме эукариотической клетки нет. Вклад RIG-I и MDA5 в распознавание конкретных вирусов зависит от того, образуют ли данные микроорганизмы соответствующие формы РНК.
ПРОВЕДЕНИЕ СИГНАЛОВ С TOLL-ПОДОБНЫХ РЕЦЕПТОРОВ
Все TLR используют одинаковую принципиальную схему передачи активационного сигнала в ядро (рис. 3-2). После связывания с лигандом рецептор привлекает один или несколько адапторов (MyD88, TIRAP, TRAM, TRIF), которые обеспечивают передачу сигнала с рецептора на каскад серин-треониновых киназ. Последние вызывают активацию факторов транскрипции NF-kB (Nuclear Factor of к-chain B-lymphocytes), AP-1 (Activator Protein 1), IRF3, IRF5 и IRF7 (Interferon Regulatory Factor), которые транслоцируются в ядро и индуцируют экспрессию геновмишеней.
Все адапторы содержат TIR-домен и связываются с TIR-доменами TOLL-подобных рецепторов (Toll/Interleukin-1 Receptor, так же как рецептора для ИЛ-1) путём гомофильного взаимодействия. Все известные TOLL-подобные рецепторы, за исключением TLR3, передают сигнал через адаптор MyD88 (MyD88-зависимый путь). Связывание MyD88 с TLR1/2/6 и TLR4 происходит при помощи дополнительного адаптора TIRAP, который не требуется в случае TLR5, TLR7 и TLR9. В передаче сигнала с TLR3 адаптор MyD88 не участвует; вместо него используется TRIF (MyD88-независимый путь). TLR4 использует как MyD88зависимый, так и MyD88-независимый пути передачи сигнала. Однако связывание TLR4 с TRIF происходит при помощи дополнительного адаптора TRAM.

Рис. 3-2. Пути передачи сигналов с Toll-подобных рецепторов (TLR). Указанные на рисунке TLR3, TLR7, TLR9 – внутриклеточные эндосомальные рецепторы; TLR4 и TLR5 – мономерные рецепторы, встроенные в цитоплазматическую мембрану. Трансмембранные димеры: TLR2 с TLR1 или TLR2 с TLR6. Тип распознаваемого димерами лиганда зависит от их состава
MyD88-зависимый путь. Адаптор MyD88 состоит из N-концевого DD-домена (Death Domain – домен смерти) и С-концевого TIRдомена, связанного с рецептором с помощью гомофильного TIR- TIR взаимодействия. MyD88 привлекает киназы IRAK-4 (Interleukin-1 Receptor-Associated Kinase-4) и IRAK-1 через взаимодействие с их аналогичными DD-доменами. Это сопровождается их последовательным фосфорилированием и активацией. После этого IRAK-4 и IRAK-1 отделяются от рецептора и связываются с адаптером TRAF6, который, в свою очередь, привлекает киназу TAK1 и убиквитин-лигазный комплекс (на рис. 3-2 не показан), что приводит к активации TAK1. TAK1 активирует две группы мишеней:
• IκB-киназу (IKK), состоящую из субъединиц IKKα, IKKβ и IKKγ. В результате фактор транскрипции NF-kB освобождается от ингибирующего его белка IκB и транслоцируется в клеточное ядро;
• каскад митоген-активируемых протеинкиназ (MAP-киназ), способствующий активации факторов транскрипции группы AP-1. Состав AP-1 варьирует и зависит от типа активирующего сигнала. Основные его формы – гомодимеры c-Jun или гетеродимеры c-Jun и c-Fos.
Результатом активации обоих каскадов является индукция экспрессии антимикробных факторов и медиаторов воспаления, в том числе фактора некроза опухолей альфа ФНОа (TNFa), который, воздействуя на клетки аутокринно, вызывает экспрессию дополнительных генов. Кроме того, AP-1 инициирует транскрипцию генов, ответственных за пролиферацию, дифференцировку и регуляцию апоптоза.
MyD88-независимый путь. Передача сигнала происходит через адаптер TRIF или TRIF:TRAM и приводит к активации киназы TBK1, которая, в свою очередь, активирует фактор транскрипции IRF3. Последний индуцирует экспрессию интерферонов I типа, которые, как и ФНОа в MyDSS-зависимом пути, воздействуют на клетки аутокринно и активируют экспрессию дополнительных генов (interferon response genes). Активация различных сигнальных путей при стимуляции TLR, вероятно, обеспечивает направленность врождённой иммунной системы на борьбу с тем или иным типом инфекции.
Сравнительная характеристика врождённых и адаптивных механизмов резистентности приведена в табл. 3-1.
Существуют субпопуляции лимфоцитов со свойствами, «промежуточными» между таковыми неклонотипных механизмов врождённого иммунитета и клонотипных лимфоцитов с большим разнообразием рецепторов для антигенов. Они не пролиферируют после связывания антигена (т.е. экспансии клонов не происходит), но в них сразу индуцируется продукция эффекторных молекул. Ответ не слишком специфичен и наступает быстрее, чем «истинно лимфоцитарный», иммунная память не формируется. К таким лимфоцитам можно отнести:
• внутриэпителиальные γδT-лимфоциты с перестроенными генами, кодирующими TCR ограниченного разнообразия, связывают лиганды типа белков теплового шока, нетипичные нуклеотиды, фосфолипиды, MHC-IB;
• B1-лимфоциты брюшной и плевральной полостей имеют перестроенные гены, кодирующие BCR ограниченного разнообразия, которые обладают широкой перекрёстной реактивностью с бактериальными антигенами.


К категории лимфоцитов с «промежуточными» свойствами относят также NK-лимфоциты, или естественные киллеры.
ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ
Особая субпопуляция лимфоцитов – естественные киллеры (NKклетки, натуральные киллеры). Они дифференцируются из общей лимфоидной клетки-предшественника и in vitro способны спонтанно, т.е. без предварительной иммунизации, убивать некоторые опухолевые, а также инфицированные вирусами клетки. NK-клетки являются большими гранулярными лимфоцитами, не экспрессирующими линейных маркёров Т- и В-клеток (CD3, CD19). В циркулирующей крови нормальные киллеры составляют около 15% всех мононуклеарных клеток, а в тканях локализованы в печени (большинство), красной пульпе селезёнки, слизистых оболочках (особенно репродуктивных органов).
Большинство NK-клеток содержит в цитоплазме азурофильные гранулы, где депонированы цитотоксические белки перфорин, гранзимы и гранулизин.
Главными функциями NK-клеток являются распознавание и элиминация клеток, инфицированных микроорганизмами, изменённых в результате злокачественного роста, либо опсонизированных IgGантителами, а также синтез цитокинов ИФНу, ФНОа, GM-CSF, ИЛ-8, ИЛ-5. In vitro при культивировании с ИЛ-2 NK-клетки приобретают высокий уровень цитолитической активности по отношению к широкому спектру мишеней, превращаясь в так называемые LAK-клетки.
Общая характеристика NK-клеток представлена на рис. 3-3. Главные маркёры NK-клеток – молекулы CD56 и CD16 (FcγRIII). CD16 является рецептором для Fc-фрагмента IgG. На NK-клетках имеются рецепторы для ИЛ-15 – ростового фактора NK-клеток, а также для ИЛ-21 – цитокина, усиливающего их активацию и цитолитическую активность. Важную роль играют молекулы адгезии, обеспечивающие контакт с другими клетками и межклеточным матриксом: VLA-5 способствует прилипанию к фибронектину; CD11a/CD18 и CD11b/CD18 обеспечивают присоединение к молекулам эндотелия ICAM-1 и ICAM-2 соответственно; VLA-4 – к молекуле эндотелия VCAM-I; CD31, молекула гомофильного взаимодействия, ответственна за диапедез (выхождение через сосудистую стенку в окружающую ткань) NK-клеток через эпителий; CD2, рецептор для эритроцитов барана, является молекулой адгезии, которая

Рис. 3-3. Общая характеристика NK-клеток. IL15R и IL21R – рецепторы для ИЛ-15 и ИЛ-21 соответственно
взаимодействует с LFA-3 (CD58) и инициирует взаимодействие NKклеток с другими лимфоцитами. Помимо CD2, на NK-клетках человека выявляются и некоторые другие маркёры Т-лимфоцитов, в частности CD7 и гомодимер CD8a, но не CD3 и TCR, что отличает их от NKTлимфоцитов.
• По эффекторным функциям NK-клетки близки к T-лимфоцитам: они проявляют цитотоксическую активность в отношении клетокмишеней по тому же перфорин-гранзимовому механизму, что и ЦТЛ (см. рис. 1-4 и рис. 6-4), и продуцируют цитокины – ИФНγ, ФНО, GM-CSF, ИЛ-5, ИЛ-8.
• Отличие естественных киллеров от T-лимфоцитов состоит в том, что у них отсутствует TCR и они распознают комплекс антиген-
MHC иным (не вполне ясным) способом. NK не формируют клетки иммунной памяти.
• На NK-клетках человека есть рецепторы, относящиеся к семейству KIR (Killer-cell Immunoglobulin-like Receptors), способные связывать молекулы MHC-I собственных клеток. Однако эти рецепторы не активируют, а ингибируют киллерную функцию нормальных киллеров. Кроме того, на NK-клетках есть такие иммунорецепторы, как FcyR, и экспрессирована молекула CD8, имеющая сродство к
MHC-I.
• На уровне ДНК гены KIR не перестраиваются, но на уровне первичного транскрипта происходит альтернативный сплайсинг, что обеспечивает определённое разнообразие вариантов этих рецепторов у каждой отдельной NK-клетки. На каждом нормальном киллере экспрессировано более одного варианта KIR.
• H.G. Ljunggren и K. Karre в 1990 г. сформулировали гипотезу «missing self» («отсутствие своего»), согласно которой NK-клетки распознают и убивают клетки своего организма с пониженной или нарушенной экспрессией молекул MHC-I. Поскольку субнормальная экспрессия MHC-I возникает в клетках при патологических процессах, например при вирусной инфекции, опухолевом перерождении, NK-клетки способны убивать инфицированные вирусами или перерождённые клетки собственного организма. Гипотеза «missing self» схематично представлена на рис. 3-4.
СИСТЕМА КОМПЛЕМЕНТА
Комплемент – система сывороточных белков и нескольких белков клеточных мембран, выполняющих 3 важные функции: опсонизацию микроорганизмов для дальнейшего их фагоцитоза, инициацию сосудистых реакций воспаления и перфорацию мембран бактериальных и других клеток. Компоненты комплемента (табл. 3-2, 3-3) обозначают буквами латинского алфавита C, B и D с добавлением арабской цифры (номер компонента) и дополнительных строчных букв. Компоненты классического пути обозначают латинской буквой «С» и арабскими цифрами (C1, C2 … C9), для субкомпонентов комплемента и продуктов расщепления к соответствующему обозначению добавляют строчные латинские буквы (C1q, C3b и т.д.). Активированные компоненты выделяют чертой над литерой, инактивированные компоненты – буквой «i» (например, iC3b).

Рис. 3-4. Гипотеза «missing self» (отсутствие своего). На рисунке представлены три типа взаимодействия NK-клеток с мишенями. На NK-клетках имеется два типа распознающих рецепторов: активационные и ингибиторные. Ингибиторные рецепторы различают молекулы MHC-I и угнетают сигнал от активационных рецепторов, которые, в свою очередь, определяют либо молекулы MHC-I (но с меньшей аффинностью, чем ингибиторные рецепторы), либо MHC-подобные молекулы: а – клетка-мишень не экспрессирует активационных лигандов, и лизиса не происходит; б – клетка-мишень экспрессирует активационные лиганды, но не экспрессирует MHC-I. Такая клетка подвергается лизису; в – клеткамишень содержит как молекулы MHC-I, так и активационные лиганды. Исход взаимодействия зависит от баланса сигналов, идущих от активационных и ингибиторных рецепторов NK-клеток
• Активация комплемента (рис. 3-5). В норме, когда внутренняя среда организма «стерильна» и патологического распада собственных тканей не происходит, уровень активности системы комплемента невысок. При появлении во внутренней среде микробных продуктов происходит активация системы комплемента. Она может происходить по трём путям: альтернативному, классическому и лектиновому.
– Альтернативный путь активации. Его инициируют непосредственно поверхностные молекулы клеток микроорганизмов [факторы альтернативного пути имеют буквенное обозначение: P (пропердин), B и D].

Рис. 3-5. Активация системы комплемента и образование мембраноатакующего комплекса. Пояснения см. в тексте, а также в табл. 3-2, 3-3. Активированные компоненты, согласно международному соглашению, надчёркнуты



◊ Из всех белков системы комплемента в сыворотке крови больше всего C3 – его концентрация в норме составляет 1,2 мг/мл. При этом всегда имеется небольшой, но значимый уровень спонтанного расщепления C3 с образованием C3a и C3b. Компонент C3b – опсонин, т.е. он способен ковалентно связываться как с поверхностными молекулами микроорганизмов, так и с рецепторами на фагоцитах. Кроме того, «осев» на поверхности клеток, C3b связывает фактор В. Тот, в свою очередь, становится субстратом для сывороточной сериновой протеазы – фактора D, который расщепляет его на фрагменты Ва и Bb. C3b и Bb образуют на поверхности микроорганизма активный комплекс, стабилизируемый пропердином (фактор Р).
◊ Комплекс C3b/Bb служит С3-конвертазой и значительно повышает уровень расщепления С3 по сравнению со спонтанным. Кроме того, после связывания с C3 он расщепляет C5 до фрагментов C5a и C5b. Малые фрагменты C5a (наиболее сильный) и C3a – анафилатоксины комплемента, т.е. медиаторы воспалительной реакции. Они создают условия для миграции фагоцитов в очаг воспаления, вызывают дегрануляцию тучных клеток, сокращение гладких мышц. C5a также вызывает повышение экспрессии на фагоцитах CR1 и CR3.
◊ С C5b начинается формирование «мембраноатакующего комплекса», вызывающего перфорацию мембраны клеток микроорганизмов и их лизис. Сначала образуется комплекс C5b/C6/ C7, встраивающийся в мембрану клетки. Одна из субъединиц компонента C8 – C8b – присоединяется к комплексу и катализирует полимеризацию 10-16 молекул C9. Этот полимер и формирует неспадающуюся пору в мембране, имеющую диаметр около 10 нм. В результате клетки становятся неспособными поддерживать осмотический баланс и лизируются.
– Классический и лектиновый пути сходны друг с другом и отличаются от альтернативного способом активации C3. Главной C3конвертазой классического и лектинового пути служит комплекс C4b/C2a, в котором протеазной активностью обладает C2a, а C4b ковалентно связывается с поверхностью клеток микроорганизмов. Примечательно, что белок C2 гомологичен фактору В, даже их гены расположены рядом в локусе MHC-III.
◊ При активации по лектиновому пути один из белков острой фазы – MBL – взаимодействует с маннозой на поверхности клеток микроорганизмов, а MBL-ассоциированная сериновая протеаза (MASP – Mannose-bindingprotein-Associated Serine Protease) катализирует активационное расщепление C4 и C2.
◊ Сериновой протеазой классического пути служит C1s, одна из субъединиц комплекса C1qr2s2. Она активируется, когда по крайней мере 2 субъединицы C1q связываются с комплексом антиген-антитело. Таким образом, классический путь активации комплемента связывает врождённый и адаптивный иммунитет.
• Рецепторы компонентов комплемента. Известно 5 типов рецепторов для компонентов комплемента (CR – Complement Receptor) на различных клетках организма.
– CR1 экспрессирован на макрофагах, нейтрофилах и эритроцитах. Он связывает C3b и C4b и при наличии других стимулов к фагоцитозу (связывания комплексов антиген-антитело через FcyR или при воздействии ИФНу – продукта активированных T-лимфоцитов) оказывает пермиссивное действие на фагоциты. CR1 эритроцитов через C4b и C3b связывает растворимые иммунные комплексы и доставляет их к макрофагам селезёнки и печени, обеспечивая тем самым клиренс крови от иммунных комплексов. При нарушении этого механизма иммунные комплексы выпадают в осадок – прежде всего в базальных мембранах сосудов клубочков почек (CR1 есть и на подоцитах клубочков почек), приводя к развитию гломерулонефрита.
– CR2 B-лимфоцитов связывает продукты деградации C3 – C3d и iC3b. Это в 10 000-100 000 раз увеличивает восприимчивость B-лимфоцита к своему антигену. Эту же мембранную молекулу – CR2 – использует в качестве своего рецептора вирус Эпштейна-Барр – возбудитель инфекционного мононуклеоза.
– CR3 и CR4 также связывают iC3b, который, как и активная форма C3b, служит опсонином. В случае если CR3 уже связался с растворимыми полисахаридами типа бета-глюканов, связывания iC3b с CR3 самого по себе достаточно для стимуляции фагоцитоза.
– C5aR состоит из семи доменов, пенетрирующих мембрану клетки. Такая структура характерна для рецепторов, связанных с G-белками (белки, способные связывать гуаниновые нуклеотиды, в том числе ГТФ).
• Защита собственных клеток. Собственные клетки организма защищены от деструктивных воздействий активного комплемента благодаря так называемым регуляторным белкам системы комплемента.
– C1-ингибитор (C1inh) разрушает связь C1q с C1r2s2, тем самым ограничивая время, в течение которого C1s катализирует активационное расщепление C4 и C2. Кроме того, C1inh ограничивает спонтанную активацию C1 в плазме крови. При генетическом дефекте dinh развивается наследственный ангионевротический отёк. Его патогенез состоит в хронически повышенной спонтанной активации системы комплемента и избыточном накоплении анафилактинов (C3a и С5а), вызывающих отёки. Заболевание лечат заместительной терапией препаратом dinh.
– C4-связывающий белок – C4BP (C4-Binding Protein) связывает C4b, предотвращая взаимодействие C4b и С2а.
– DAF (Decay-Accelerating Factor – фактор, ускоряющий деградацию, CD55) ингибирует конвертазы классического и альтернативного путей активации комплемента, блокируя формирование мембраноатакующего комплекса.
– Фактор H (растворимый) вытесняет фактор В из комплекса с C3b.
– Фактор I (сывороточная протеаза) расщепляет C3b на C3dg и iC3b, а C4b – на C4c и C4d.
– Мембранный кофакторный белок MCP (Membrane Cofactor Protein, CD46) связывает C3b и C4b, делая их доступными для фактора I.
– Протектин (CD59). Связывается с C5b678 и предотвращает последующее связывание и полимеризацию С9, блокируя тем самым образование мембраноатакующего комплекса. При наследственном дефекте протектина или DAF развивается пароксизмальная ночная гемоглобинурия. У таких больных эпизодически возникают приступы внутрисосудистого лизиса собственных эритроцитов активированным комплементом и происходит экскреция гемоглобина почками.
ФАГОЦИТОЗ
Фагоцитоз – особый процесс поглощения клеткой крупных макромолекулярных комплексов или корпускулярных структур. «Профессиональные» фагоциты у млекопитающих – два типа дифференцированных клеток – нейтрофилы и макрофаги, которые созревают в костном мозге из СКК и имеют общую промежуточную клетку-предшественник. Сам термин «фагоцитоз» принадлежит И.И. Мечникову, который описал клетки, участвующие в фагоцитозе (нейтрофилы и макрофаги), и основные стадии фагоцитарного процесса: хемотаксис, поглощение, переваривание.
Нейтрофилы составляют значительную часть лейкоцитов периферической крови – 60-70%, или 2,5-7,5х109 клеток в 1 л крови. Нейтрофилы формируются в костном мозге, являясь основным продуктом миелоидного кроветворения. Они покидают костный мозг на предпоследней стадии развития – палочкоядерной форме, или на последней – сегментоядерной. Зрелый нейтрофил циркулирует 8-10 ч и поступает в ткани. Общая продолжительность жизни нейтрофила –
2-3 сут. В норме нейтрофилы не выходят из сосудов в периферические ткани, но они первыми мигрируют (т.е. подвергаются экстравазации) в очаг воспаления за счёт быстрой экспрессии молекул адгезии – VLA-4 (лиганд на эндотелии – VCAM-1) и интегрина CD11b/CD18 (лиганд на эндотелии – ICAM-1). На их наружной мембране выявлены эксклюзивные маркёры – CD66а и CD66d (раково-эмбриональные антигены). На рисунке 3-6 представлено участие нейтрофилов в фагоцитозе (миграция, поглощение, дегрануляция, внутриклеточный киллинг, деградация, экзоцитоз и апоптоз) и основные процессы, происходящие в этих клетках при активации (хемокинами, цитокинами и микробными веществами, в частности РАМР) – дегрануляция, образование активных форм кислорода и синтез цитокинов и хемокинов. Апоптоз нейрофилов и их фагоцитоз макрофагами можно рассматривать как важную составную часть воспалительного процесса, так как своевременное их удаление препятствует деструктивному действию их ферментов и различных молекул на окружающие клетки и ткани.

Рис. 3-6. Основные процессы, происходящие в нейтрофилах (НФ) при их активации и фагоцитозе
Моноциты и макрофаги. Моноциты являются «промежуточной формой», в крови их 5-10% от общего числа лейкоцитов. Их назначение – стать оседлыми макрофагами в тканях (рис. 3-7). Макрофаги локализуются в определённых участках лимфоидной ткани: медуллярных тяжах лимфатических узлов, красной и белой пульпы селезёнки. Клетки, производные моноцитов, присутствуют практически во всех нелимфоидных органах: клетки Купфера в печени, микроглия нервной системы, альвеолярные макрофаги, клетки Лангерганса кожи, остеокласты, макрофаги слизистых оболочек и серозных полостей, интерстициальной ткани сердца, поджелудочной железы, мезангиальные клетки почек (на рисунке не показаны). Макрофаги способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы. Макрофаги

Рис. 3-7. Гетерогенность клеток, происходящих от моноцитов. Тканевые макрофаги (МФ) и дендритные клетки (ДК) происходят от моноцитов (МН) периферической крови
слизистых оболочек играют ведущую роль в защите организма. Для реализации этой функции они имеют набор распознающих рецепторов, кислородозависимые и кислородонезависимые механизмы киллинга микроорганизмов. Существенную роль в защите организма от инфекции играют макрофаги альвеолярные и слизистой оболочки кишечника. Первые «работают» в относительно бедной опсонинами среде, поэтому они экспрессируют большое количество паттернраспознающих рецепторов, включая скавенджер-рецепторы, маннозные рецепторы, β-глюканспецифические рецепторы, дектин-1 и др. При микробной инфекции в очаг проникновения микробов дополнительно мигрирует большое число воспалительных моноцитов, способных дифференцироваться в различные клеточные линии в зависимости от цитокинового окружения.
Рецепторы мембраны макрофагов
• CD115 (CSF-1R) – рецептор для моноцитарного колониестимулирующего фактора (M-CSF). Присутствует также на мембране полипотентной клетки-предшественника гранулоцитов и моноцитов и унипотентного предшественника моноцитов.
• Рецепторы клеточной мембраны макрофагов, участвующие в процессе фагоцитоза.
– CD14 – рецептор для комплексов бактериальных ЛПС с белками сыворотки крови, связывающими ЛПС (LBP), а также липоарабиноманнана клеточной стенки микобактерий и липотейхоевой кислоты грамположительных бактерий.
– Рецепторы для фрагментов фосфолипидных мембран и других компонентов собственных повреждённых и умирающих клеток (рецепторы-«мусорщики», scavenger receptors). Таков, например, CD163 – рецептор для «старых» эритроцитов.
– Рецептор, связывающий маннозу (Macrophage Mannose Receptor). Присутствует на мембране тканевых макрофагов и через маннозосодержащие поверхностные структуры связывает бактерии, вирусы и грибки.
– Рецепторы для комплемента – CR3 (интегрин CD11b/CD18) и CR4 (интегрин CD11c/CD18). Помимо комплемента они связывают и ряд бактериальных продуктов: ЛПС, липофосфогликан Leishmania, гемагглютинин из филаментов Bordetella, поверхностные структуры дрожжевых клеток Candida и грибков Histoplasma.
– CD64 – рецептор для Fc-фрагментов IgG – FcγRI (Fcy-рецептор первого типа), обеспечивающий фагоцитоз макрофагами иммунных комплексов. Сила связывания FcyRI с иммуноглобулинами различных изотипов убывает в ряду: IgG3 > IgG1 > IgG4 >
IgG2.
• Рецепторы, осуществляющие взаимодействие с лимфоцитами. Наряду с уже упомянутым CD64 к ним относят:
– рецепторы для цитокинов, вырабатываемых активированными лимфоцитами. Связывание с ИФНу и фактором некроза опухоли (ФНО) активирует макрофаг. Через рецептор для ИЛ-10 макрофаг, напротив, инактивируется;
– CD40, B7, MHC-II – мембранные молекулы для контактов с комплементарными мембранными молекулами лимфоцитов, т.е. для непосредственных межклеточных взаимодействий. У нейтрофилов такие рецепторы отсутствуют.
Последствия фагоцитоза. После того как фагоцит охватывает своей мембраной поглощаемый объект и заключает его в мембранную везикулу, называемую фагосомой, происходят следующие события.
• Расщепление фагоцитированного материала. Этот процесс идёт по одинаковым биохимическим механизмам во всех фагоцитах.
– Лизосомы – специальные внутриклеточные органеллы, содержащие набор гидролитических ферментов (кислых протеаз и гидролаз) с оптимумом pH порядка 4,0. В клетке лизосомы сливаются с фагосомами в фаголизосому, где и происходят реакции расщепления поглощённого материала.
– Ферментные системы. НАДФ-Н-оксидазы, супероксиддисмутаза, NO-синтазы, генерируют активные формы неорганических окислителей, участвующих в деструкции фагоцитированного объекта: пероксид водорода (Н2О2), супероксид анион (О2–), синглетный кислород (1O2), радикал гидроксила (OH–), гипохлорид (OCl–), оксид азота (NO). Активация НАДФ-Н-оксидазы приводит к формированию так называемого «кислодородного взрыва» (рис. 3-8). Первичным продуктом «кислородного взрыва» является супероксидный анион О2–, который образуется при переносе НАДФ-H-оксидазой электрона на кислород. Супероксидный анион обладает слабым бактерицидным эффектом и является недолговечным. В результате реакции, катализируемой ферментом супероксидисмутазой (СОД), из двух молекул супероксидного аниона формируется перекись водорода, обла-

Рис. 3-8. Образование активных форм кислорода фагоцитами («кислородный взрыв»). Обозначения: NADPH-оксидаза – НАДФ-Н-оксидаза, NADP – НАДФ
дающая сильным микробицидным эффектом. При окислении хлоридов перекисью водорода в присутствии миелопероксидазы (МПО) образуется мощный цитотоксический агент – гипохлорная кислота HOCl, при её окислении супероксидным радикалом – гидроксильный радикал ОН, при окислении гипохлорит-иона перекисью водорода формируется синглетный кислород 1О2, который является источником образования другого бактерицидного вещества – озона О3 (на рис. не показан). При взаимодействии гипохлорной кислоты с аминогруппой
формируется микробицидное производное монохлорамина – R-NHCl.
• Секреция литических ферментов и окислительных радикалов в межклеточное пространство, где они также оказывают бактерицидное действие, но при этом поражают и собственные ткани. Нейтрофилы, помимо уже названных веществ, продуцируют и секретируют коллагеназу, катепсин G, желатиназу, эластазу и фосфолипазу A2.
• Образование и секреция цитокинов. Макрофаги и нейтрофилы, активированные продуктами микроорганизмов, начинают продуцировать цитокины и другие биологически активные медиаторы, инициирующие воспалительные реакции в очаге проникновения чужеродных агентов, подготавливая возможность развития адаптивного иммунного ответа.
– Макрофаги продуцируют интерлейкины (ИЛ-1, ИЛ-6, ИЛ-12); хемокин ИЛ-8; фактор некроза опухоли а (ФНОа); простагландины; лейкотриен В4 (LTB4); фактор, активирующий тромбоциты (ФАТ).
– Нейтрофилы продуцируют ФНОа, ИЛ-12, хемокин ИЛ-8, LTB4
и ФАТ.
• Процессинг и презентация антигена – образование внутри клеток комплексов из продуктов расщепления фагоцитированного материала с собственными молекулами MHC-II и экспрессия этих комплексов на поверхности клетки для презентации антигенов T-лимфоцитам. Этот процесс осуществляется АПК: ДК, макрофагами и др.
ЭНДОГЕННЫЕ ПРОТИВОМИКРОБНЫЕ ПЕПТИДЫ – ПРИРОДНЫЕ АНТИБИОТИКИ
Пептиды, обладающие активностью антибиотиков, обнаружены в клетках многих эукариот – от растений до человека. Они образуются путём процессинга более крупных белков-предшественников и содержат 13-80 аминокислотных остатков. Изучение противомикробных пептидов в настоящее время – это одно из самых новых направлений исследований. В базе данных о пептидах-антибиотиках содержится свыше 1200 наименований.
Выделяют несколько групп пептидов-антибиотиков, из которых для человека важны так называемые дефензины – пептиды, содер-
жащие несколько цистеинов, между которыми сформированы 3 дисульфидные связи. α-Дефензины содержатся в гранулах нейтрофилов. Синтез β-дефензинов происходит в клетках покровных тканей – эпителия дыхательных путей и пищеварительного тракта (рис. 3-9). Главными источниками α-дефензинов I-IV типов являются нейтрофилы и макрофаги, α-дефензинов V-VI типов – клетки Пеннета кишечника; β-дефензинов – эндотелиоциты и кератиноциты. Дефензины являются многофункциональными агентами, играющими важную роль в процессе фагоцитоза и воспаления. Первый эффект – способность убивать бактерии, грибы, оболочечные вирусы. Он может реализовываться внутриклеточно (в фаголизосоме) и внеклеточно. В результате экзоцитоза довольно большие концентрации дефензинов могут накапливаться в воспалительном очаге. Дефензины индуцируют синтез ИЛ-8 и сами являются хемоаттрактантами. Они оказывают ряд не-

Рис. 3-9. Дефензины и их роль в процессе воспаления и фагоцитоза: а – источники дефензинов; б – эффекты дефензинов. Обозначения: МН – моноциты
специфических эффектов: стимулируют ангиогенез, заживление ран, индуцируют апоптоз и ингибируют синтез ФНОа, что важно на заключительных этапах воспаления. Вместе с тем дефензины стимулируют дифференцировку ДК.
Генетические дефекты пептидов-антибиотиков или необходимых для их функционирования кофакторов (например, ионных каналов, так как активность пептидов-антибиотиков «высокочувствительна» к ионной силе), вероятно, коррелируют с развитием прогредиентно текущей хронической патологии с инфекционными факторами в этиологии. Например, на сегодняшний день доказана связь развития муковисцидоза с мутацией гена регулятора мембранной проводимости CFTR, которая, возможно, определяет снижение активности β-дефензина в эпителии дыхательных путей.
ИНТЕРФЕРОНЫ ТИПА I
Как факторы противовирусной защиты интерфероны были открыты в 1957 г. А. Isaacs и J. Lindenmann. Выделяют интерфероны I, II и III типов. У человека тип I включает ИФНα, ИФНβ, ИФНκ, ИФНω, ИФНε. Главная роль во врождённой защите от вирусов принадлежит ИФНα (включает 13 членов) и ИФНβ (представлен одним членом). ИФНα и ИФНβ состоят из одной α-спиральной цепи из 165 и 166 аминокислотных остатков соответственно. Гомология между цепями составляет около 70%. К интерферонам типа II относится ИФНγ, а к интерферонам III типа – интерфероноподобные цитокины ИФН-λ1 (ИЛ-29), ИФН-λ2 (ИЛ-28A) и ИФН-λ3 (ИЛ-28B).
Считают, что основной источник интерферонов типа I в организме – плазмоцитоидные ДК. Интерфероны – небольшие белки, синтезируемые в инфицированных вирусом клетках. Индуктором синтеза интерферонов служат молекулы двуспиральной РНК. Двуспиральная РНК может быть геномной РНК вирусов или промежуточным продуктом транскрипции у ДНК-содержащих вирусов. В клетках млекопитающих собственных двуспиральных РНК нет.
Интерфероны типа I связываются со специфическими рецепторами на поверхности многих типов клеток иммунной системы и стимулируют противовирусный и в некоторых случаях противоопухолевый иммунный ответ. Подробнее эти действия описаны ниже и представлены на рис. 3-10.

Рис. 3-10. Функции ИФНα/β
Влияние ИФНα/β на дендритные клетки и В-лимфоциты (рис. 3-11)
ИФНα/β стимулируют превращение незрелых ДК (1) в зрелые (2). Это приводит к усилению ими синтеза цитокинов, хемокинов, экспрессии молекул МНС, особенно I класса, костимуляторных молекул, экспрессии и секреции главных факторов выживания и активации В2клеток – BAFF и APRIL. Эти лиганды, взаимодействуя с рецепторами В-клеток BAFFR и TACI соответственно, при участии цитокинов ИЛ10, ТФРβ и ИЛ-15, синтезируемых активированными ДК, вызывают в наивных В-клетках (3) переключение иммуноглобулиновых генов CμСγ и Cμ-Сα и их созревание в IgG(4)- и IgA(5)-плазмабласты. ИФНα/β вызывают активацию макрофагов с теми же последствиями, что и для ДК (на рис. 3-11 не показано). ИФНα/β являются необходимыми цитокинами для созревания и пролиферации В1-клеток – главных продуцентов естественных аутоантител в организме.
Влияние ИФНα/в на Т-клетки (рис. 3-11)
ИФНα/β способствуют выживанию и пролиферации CD4+ и CD8+ T-клеток. ИФНα/β усиливают цитотоксические свойства CD8+Т-клеток, а также макрофагов и NK-клеток (на рис. 3-11 не показано). Вместе с тем ИФНα/β оказывают мощное антипролиферативное и проапоптозное действие, усиливая экспрессию проапоптотических молекул. Наличие одновременно пролиферативных и антипролиферативных свойств

Рис. 3-11. Влияние ИФНα/β на клетки иммунной системы. Обозначения: Blys и April – факторы выживания и активации В2-клеток BAFF и APRIL; BAFFR и TACI – рецепторы В-клеток. Этапы 1-5 описаны в тексте
связано, вероятно, с включением на различных этапах инфекционного процесса или адаптивного иммунного ответа различных регуляторных механизмов, определяющих чувствительность клетки к действию ИФНа/р.
Интерфероны типа I индуцируют ферменты, нарушающие репликативный цикл вирусов:
• олигоаденилатсинтетазу, полимеризующую АТФ в 2′,5′-олигомеры (в норме нуклеотиды в нуклеиновых кислотах связаны по 3′,5′). Аномальные 2′,5′-олигомеры активируют эндорибонуклеазу, которая расщепляет их и заодно вирусные нуклеиновые кислоты;
• серинтреониновую киназу Р1 , фосфорилирующую фактор инициации синтеза белка эукариот eIF-2, что приводит к подавлению трансляции, в том числе и вирусных белков;
• белок MX – клеточный белок, необходимый для проявления резистентности клетки к размножению в ней вируса гриппа (по данным генетического нокаута гена mx).
ФАКТОРЫ ВРОЖДЁННОГО ИММУНИТЕТА
В табл. 3-4 перечислены различные факторы (молекулы) врождённой резистентности, относящиеся к разным функциональным классам (лектины, ЛПС-реактивные белки, активаторы комплемента, цитокины, липидные медиаторы, реактанты острой фазы, пентраксины).



Глава 4. ИММУННЫЙ ОТВЕТ
Механизмы врождённого иммунитета не всегда могут сдержать развитие инфекции. В таких случаях запускается адаптивный иммунный ответ. В отличие от врождённого иммунитета, реализуемого клетками, сформировавшимися в процессе онтогенеза независимо от контакта с патогенными микроорганизмами, адаптивный иммунный ответ развивается только в ответ на контакт с конкретным антигеном. При этом в иммунный ответ вовлекаются только клоны лимфоцитов, распознающие проникшие в организм чужеродные антигены. Эта специфическая адресная реакция называется иммунным ответом. Таким образом, иммунный ответ – многоэтапный процесс с обязательным участием лимфоцитов и других клеток иммунной системы.
Основные задачи иммунного ответа:
• распознавание лимфоцитами антигена в нативном состоянии (например, молекулы патогена) и представленного на поверхности модифицированных клеток (например, заражённых вирусами);
• деструкция патогена и повреждённых клеток;
• элиминация (выведение) продуктов деструкции из организма;
• формирование иммунной памяти.
В иммунном ответе выделяют индуктивную и эффекторную (продуктивную) фазы. В индуктивную фазу происходит презентация антигена, т.е. передача информации об антигене от клеток врождённого иммунитета (АПК) инициаторам адаптивного иммунитета – Т-хелперам. Затем выбирается путь дальнейшего развития иммунного ответа по клеточному или гуморальному пути: через индукцию дифференцировки разновидностей Т-хелперов (Th1, Th2, Th17 и других, см. главу 6). Наконец, при участии этих Т-хелперов происходит параллельная дифференцировка эффекторных клеток и клеток памяти. Эффекторная фаза иммунного ответа состоит в выполнении своих функций образовавшимися эффекторными клетками. Эта активность реализуется в форме клеточной или гуморальной иммунной защиты. В конце иммунного ответа благодаря включению регуляторных механизмов прогрессирование иммунных

Рис. 4-1. Основные события иммунного ответа
реакций замедляется и в результате приводит к их прекращению. Дифференцировавшиеся в процессе иммунного ответа клетки памяти активируются только при повторной встрече с антигеном – при вторичном иммунном ответе. Он протекает в принципе так же, как первичный, но развивается быстрее и реализуется значительно эффективнее первичного (рис. 4-1).
ПРИЗНАКИ АДАПТИВНОГО ИММУННОГО ОТВЕТА
• Клоны лимфоцитов. Лимфоциты – единственный тип клеток в организме, при дифференцировке которых происходит обязательная рекомбинация ДНК в генах, кодирующих антигенраспознающие рецепторы. Таким образом, в организме непрерывно генерируется беспрецедентное разнообразие клонов лимфоцитов, несущих антигенраспознающие рецепторы различной специфичности. У Т-лимфоцитов возможно 1018 вариантов специфичностей и 1016 вариантов у B-лимфоцитов.
• Связывание антигенраспознающего рецептора лимфоцита со специфичным лигандом необходимо, но ещё недостаточно для инициации иммунного ответа.
• Корецепторы. Помимо антигенраспознающего рецептора на мембране лимфоцитов есть инвариантные корецепторы, строго необходимые для развития иммунного ответа.
• Для инициации иммунного ответа лимфоциту необходимо получить сигналы по «двум каналам» – от рецепторов для антигена и от корецепторов.
• Дополнительные активирующие сигналы через корецепторы поступают в лимфоциты от АПК (ДК, макрофагов, покровного эпителия и др.).
• Клетки врождённого иммунитета не имеют большого разнообразия рецепторов. Их рецепторы инвариантны, консервативны, кодируются зародышевыми генами, но именно эти рецепторы первыми избирательно связывают продукты микроорганизмов, отсутствующие у макроорганизмов. Таким образом, именно рецепторы клеток врождённого иммунитета – «носители эволюционной памяти», именно они первыми отличают «чужое» от «своего» и информируют лимфоциты о факте проникновения «чужого» во внутреннюю
среду.
• При инициации иммунного ответа в лимфоидных органах лимфоцит распознаёт антиген и связывает лиганд и затем под влиянием стимулирующих и костимулирующих сигналов активируется и пролиферирует. В-лимфоцит додифференцируется в лимфоидных органах в плазматические клетки, вырабатывающие специфичные к антигену антитела. Антителообразование происходит в том же лимфоидном органе, либо плазматические клетки мигрируют в костный мозг, где происходят те же самые процессы. Сенсибилизированные Т-лимфоциты, как и В-лимфоциты, мигрируют в очаг поражения в ткани (выходят из крови), где разрушают инфицированные клетки, либо выделяют цитокины, вовлекающие в эту деструкцию макрофаги, эозинофилы, нормальные киллеры и другие лейкоциты.
ЭТАПЫ РАЗВИТИЯ ИММУННОГО ОТВЕТА
• Началом процесса служит проникновение антигена во внутреннюю среду организма. В природе это происходит при повреждении покровных тканей. При этом в них выделяются определённые вещества (стресс-протеины, белки теплового шока, цитокины кератиноцитов и клеток соединительной ткани) – медиаторы воспа-
ления, которые и «подготавливают почву» для развития адаптивного иммунного ответа (если это потребуется). Попадание антигена без значимого нарушения целостности покровов сразу во внутреннюю среду – событие редкое. Чаще это происходит при искусственных вмешательствах, например при парентеральном введении веществ.
• Врождённые защитные реакции на антигены направлены на предотвращение проникновения антигенов глубже покровных тканей. В первую очередь это сосудистые реакции: расширение сосудов микроциркуляторного русла, повышенный выпот из сосудов в ткани плазмы или сыворотки (соответственно, и всех сывороточных неспецифических противоинфекционных факторов) и экстравазация лейкоцитов (в первую очередь фагоцитов-нейтрофилов). Локальный отёк препятствует проникновению антигенов в системную циркуляцию.
– Проникший в покровы патоген поглощают ДК и/или макрофаги при помощи эндоцитоза (чаще всего – фагоцитоза). И те, и другие – профессиональные АПК, однако ДК обладают особыми свойствами и мигрируют из покровов (вместе с антигенами) в региональные лимфоидные органы. ДК процессируют антигены, проходят этапы созревания, экспрессируют на мембране комплексы пептидов с молекулами MHC-II и необходимые корецепторные молекулы, с помощью которых они могут эффективно взаимодействовать с T-лимфоцитами в T-зависимых зонах периферических лимфоидных органов.
– Кроме АПК в покровных тканях с антигенами контактируют внутриэпителиальные лимфоциты, среди которых много γδT-клеток, распознающих непептидные антигены без предварительной презентации АПК. Под покровными тканями в плевральной и брюшной полостях присутствуют B1-лимфоциты, продуцирующие антитела с широкой перекрёстной реактивностью, специфичные в основном к распространённым бактериальным антигенам и аутоантигенам.
– Не «перехваченный» в барьерных тканях антиген может поступить непосредственно в системную циркуляцию. Тем не менее иммунный ответ на него ещё может развиться, поскольку АПК (ДК и макрофаги) присутствуют и в синусоидах селезёнки, через которую проходит весь объём крови.
• В T-зависимых зонах лимфатических узлов ДК презентируют антигены (в комплексе с MHC-II) интенсивно рециркулирую-
щим T-лимфоцитам, как бы проверяя их специфичность. Среди T-клеток рано или поздно встретится лимфоцит, несущий рецептор, специфичный к данному антигену. Если при этом состоятся все необходимые и достаточные корецепторные взаимодействия с АПК, T-лимфоцит получит активационный сигнал, что и станет началом собственно антигенспецифичного иммунного ответа.
– Двойное распознавание – процесс распознавания фрагментов пептидного антигена, в комплексе с молекулами МНС-I (CD8+ ЦТЛ) или МНС-II (CD4+ Т-хелпером). При этом Т-лимфоциты инициируют иммунный ответ против чужеродного антигена, презентированного АПК в комплексе со «своими» молекулами MHC-II или против клеток собственного организма, несущих вирусные или изменённые свои пептиды в комплексе с MHC-I.
• Распознавший антиген T-лимфоцит начинает пролиферировать и дифференцироваться. В результате образуется клон дифференцированных антигенспецифичных T-лимфоцитов. Такие T-клетки называют лимфоцитами-эффекторами. В процессе дифференцировки T-лимфоциты экспрессируют в надлежащем количестве мембранные молекулы и секретируют цитокины, необходимые для взаимодействия с B-лимфоцитами, лейкоцитами или для атаки клеток-мишеней.
• В T-зависимых зонах периферических лимфоидных органов происходит взаимодействие активированных антигеном T-лимфоцитов с активированными антигеном B-лимфоцитами.
• Провзаимодействовавшие с антигеном и с T-клетками B-лимфоциты мигрируют в зону лимфоидного фолликула, где пролиферируют и дифференцируются в антителопродуценты – плазматические клетки.
– Часть плазматических клеток остается в лимфатическом узле. Секретируемые ими антитела в значительном количестве связываются рецепторами для Fc-фрагмента антител (FcR) ФДК и в таком виде способны в течение продолжительного времени удерживать антиген в лимфоидном фолликуле.
– Остальные плазматические клетки уходят из фолликулов лимфоидных органов и мигрируют преимущественно в костный мозг или слизистые оболочки, где и осуществляют массовое образование антител, секретируя их в кровь или во внешнюю среду.
• Активированные Т-лимфоциты (ЦТЛ, Th1, Th2) выходят из региональных лимфатических узлов через эфферентные лимфатические сосуды, попадают в системную циркуляцию, а оттуда – в очаг воспаления в месте проникновения или диссеминации патогена.
• Если T-лимфоциты в очаге воспаления находят и связывают специфичный антиген, они начинают усиленно синтезировать и секретировать эффекторные молекулы – цитотоксины (ЦТЛ), непосредственно вызывающие гибель клеток-мишеней, или цитокины (Th1 или Th2), вовлекающие в деструкцию антигена другие лейкоциты (макрофаги, эозинофилы, тучные клетки, базофилы, нейтрофилы), в том числе различные популяции лимфоцитов.
• В конечной фазе иммунного ответа связанный антиген подвергается фагоцитозу и последующему разрушению гидролитическими ферментами, кислородными радикалами и радикалами оксида азота до мелких метаболитов, выводимых из организма через почки и пищеварительный тракт.
• Если санация организма от патогена/антигена завершается успешно – первый результат достигнут. После этого в норме происходит остановка продуктивного иммунного ответа – так называемая супрессия.
• Второй результат адаптивной иммунной реакции – формирование иммунной памяти. По современным представлениям лимфоцитами иммунной памяти становится незначительная часть покоящихся лимфоцитов (вероятно, единицы процентов), экспрессирующих особые ингибирующие активацию молекулярные структуры.
На рис. 4-2 представлена временная динамика иммунного ответа в различных проявлениях и с разными результатами.
МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ КЛЕТОК В ХОДЕ ИММУННОГО ОТВЕТА
При развитии иммунного ответа разные клетки взаимодействуют друг с другом. Известны как минимум 2 механизма такого взаимодействия:
• межклеточная адгезия (контактное взаимодействие) – мембранные молекулы одной клетки комплементарно связываются с мембранными молекулами другой клетки, что приводит к образованию межклеточного контакта;

Рис. 4-2. Временная динамика проявлений адаптивной иммунной защиты при инфекции
• взаимодействие при помощи медиаторов – клетка секретирует особые растворимые молекулы (медиаторы), рецепторы к которым присутствуют на мембранах других клеток. При связывании рецептора с лигандом реализуется тот или иной биологический эффект. Медиаторы, участвующие в развитии иммунного ответа, называют цитокинами и хемокинами.
Молекулы межклеточной адгезии
К молекулам межклеточной адгезии относят селектины, адрессины, интегрины, молекулы суперсемейства иммуноглобулинов и ряд других.
• Селектины – трансмембранные белки на поверхности лимфоцитов, лейкоцитов, тромбоцитов и эндотелиоцитов. Общим для них является наличие во внеклеточной части лектиноподобного домена, способного комплементарно связывать сахара.
• Адрессины – муциноподобные молекулы на мембране эндотелиоцитов – лиганды для селектинов. Селектины и адрессины обеспечивают селективную адгезию клеток к стенке сосуда, необходимую для их экстравазации и дальнейшего проникновения в очаг поражения.
• Интегрины – гетеродимерные белки, состоящие из крупной а-цепи и меньшей по размеру в-цепи.
– LFA-1 (Lymphocyte Function-Associated antigen – антиген, ассоциированный с функцией лимфоцитов) – наиболее важный интегрин для активации любого T-лимфоцита. Антитела к LFA-1 способны блокировать активацию как наивных, так и покоящихся T-клеток. Однако анализ врождённых генетических дефектов молекул адгезии показывает, что другие интегрины (например, CD2) способны компенсировать отсутствие LFA-1.
– VLA (Very Late Activation antigens – очень поздние антигены активации). Эти интегрины экспрессируются T-лимфоцитами на 2-4-е сутки после активации и имеют наибольшее функциональное значение для проникновения уже стимулированной T-клетки в очаг воспаления, где ей надлежит организовать элиминацию антигена.
• ICAM (InterCellular Adhesion Molecules – молекулы межклеточной адгезии) относят к суперсемейству иммуноглобулинов.
– Взаимодействие молекул адгезии LFA-3 и ICAM-1 на клетках эпителия тимуса с комплементарными им молекулами CD2 и LFA-1 на тимоцитах необходимо для удержания последних в тимусе в процессе их дифференцировки.
– Наивные T-лимфоциты в T-зависимых зонах периферических лимфоидных органов взаимодействуют с АПК при помощи LFA-1, CD2 и ICAM-3 на T-клетках и ICAM-1, ICAM-2, LFA-1 и LFA-3 на АПК. Этого взаимодействия достаточно для запуска пролиферации распознавших антиген T-лимфоцитов и дифференцировки их в лимфоциты-эффекторы.
Данные по отдельным молекулам адгезии приведены в табл. 4-1.


Цитокины
Взаимодействия, опосредованные цитокинами, более динамичны и оперативны, чем адгезивные. Для цитокинов характерны общие свойства.
• Разные типы клеток могут продуцировать одинаковые цитокины и экспрессировать рецепторы для них.
• Действие цитокинов избыточно. С одной стороны, разные цитокины могут вызывать внешне одинаковые реакции клеток, с другой – каждый цитокин индуцирует в разных клетках разные биологические эффекты.
• В подавляющем большинстве случаев цитокины – близкодействующие медиаторы, обусловливающие локальные взаимодействия клеток в очагах развития процессов в тканях.
– В зависимости от клетки-мишени выделяют аутокринные эффекты (действуют на саму клетку, секретировавшую цитокин) и паракринные эффекты (действуют на другие рядом расположенные клетки) цитокинов.
– Эндокринные (дистантные, или системные) эффекты проявляются, когда цитокин достигает клетки-мишени, циркулируя с кровью. У здоровых людей в крови обычно удаётся обнаружить множество разных цитокинов, включая интерфероны, но в концентрациях, не превышающих несколько пикограмм (10-12 г) в 1 мл. Системное действие выявлено в основном для четырёх цитокинов: ФНОа, ИЛ-1, ИЛ-6 и M-CSF, например при тяжёлой патологии типа септического шока, и опосредовано через гипоталамус и печень.
• Большинство цитокинов не депонируются в клетках, а синтезируются импульсно – «по запросу». Этот процесс начинается с транскрипции мРНК с соответствующего гена цитокина. Тем не менее небольшие количества ФНОα или других цитокинов могут депонироваться в гранулах нейтрофилов, тромбоцитов и тучных клеток.
• Матричная РНК цитокинов очень короткоживущая, что объясняет транзиторный характер их продукции клеткой: они вырабатываются непродолжительное время после получения «запроса» на их образование.
• Для действия цитокинов характерна каскадность, выражающаяся в том, что под влиянием одного цитокина клетка может начать вырабатывать другие цитокины (или тот же самый). Это приводит к усилению биологических эффектов.
• Каскад цитокинов саморегулируется: клетка, начавшая продуцировать активационные цитокины, через несколько часов или суток переключается на синтез супрессорных цитокинов и/или экспрессирует ингибиторные рецепторы либо рецепторы для сигналов к апоптозу.
По функциональному назначению выделяют 5 основных групп цитокинов (подробнее см. табл. 4-2).
Группа 1. Гемопоэтические цитокины регулируют пролиферацию и дифференцировку всех клеток кроветворной системы. К ним относят колониестимулирующие факторы – CSF (Colony Stimulating Factors): GM-CSF, M-CSF, G-CSF, эритропоэтин, тромбопоэтин, ИЛ-3 (мульти-CSF), ИЛ-5 (CSF для эозинофилов), ИЛ-7 (CSF для лимфоцитов), фактор стволовых клеток – SCF (Stem Cell Factor, его второе название «c-kit-лиганд»). К гемопоэтинам относят и ИЛ-1а под вторым названием – гемопоэтин-1, так как он поддерживает рост самых ранних клеток-предшественников кроветворения. Негативные регуляторы гемопоэза – ФНОа и трансформирующий фактор роста β (ТФРβ). Хемокин MIPα ингибирует ранние клетки-предшественники гемопоэза.
В процессе гемопоэза цитокины выступают в качестве факторов выживания и роста дифференцирующихся клеток-предшественников и их потомков, но не являются дифференцировочными факторами. Один и тот же цитокин может действовать на разных уровнях и в разных рядах дифференцировки. В миелоидном ряду проявляется правило, согласно которому влияние цитокинов (например, ИЛ-3, GM-CSF), действующих на ранних этапах развития клеток, сохраняется на поздних этапах развития, когда к «ранним» цитокинам присоединяются более специализированные факторы (такие, как G-CSF, M-CSF). В лимфоидном ряду первоначальное преобладание эффекта SCF постепенно замещается универсальным действием ИЛ-7, а на поздних этапах доминирующими наряду с ИЛ-7 становятся линейно-специфические факторы. На рис. 4-3 цитокины, контролирующие рост и выживание гемопоэтических клеток, показаны около стрелок, указывающих направление дифференцировки клеток-предшественников. Подробнее о функциях ИЛ-15, BAFF и Flt3L см. в табл. 4-2.
Группа 2. Первичные провоспалительные цитокины (цитокины врождённого иммунитета) – ИЛ-1а, ИЛ-1в, ФНОа и ИЛ-6. Они чрезвычайно плейотропны и действуют на клетки близлежащих тканей. Их продуцируют главным образом макрофаги и ДК покровных структур в очаге внедрения патогена. ИЛ-1 и ФНОа действуют преимущественно

Рис. 4-3. Цитокиновый контроль гемопоэза. Обозначения: Бф – базофил; Эо – эозинофил; Нф – нейтрофил; Мон – моноцит; МФ – макрофаг; ТК – тучная клетка; ЛАК – лимфокин-активированный киллер; Вакт, Такт – активированные формы В- и Т-клеток соответственно; GM-предшественник – предшественник нейтрофильных гранулоцитов, моноцитов/макрофагов и ДК; пре-G – предшественник нейтрофильных гранулоцитов; пре-М – предшественник моноцитов/макрофагов; L-предшественник – предшественник лимфоцитов; Flt3L – Fms-like tyrosinekinase
локально (если нет септического заражения крови), а ИЛ-6 индуцирует биосинтез белков острой фазы в печени.
Группа 3. Иммунорегуляторные цитокины регулируют пролиферацию и дифференцировку T- и B-лимфоцитов и NK-клеток в периферических лимфоидных органах и тканях. В первую очередь их продуцируют активированные профессиональные АПК (макрофаги и ДК) и сами лимфоциты. К этой группе относят ИЛ-2 (митоген для лимфоцитов), ИЛ-4, ИЛ-12, ИЛ-15, ИФНγ.
Группа 4. Цитокины – медиаторы воспаления являются продуктами активированных T-лимфоцитов и вызывают активацию лейкоцитов «общевоспалительного назначения»: ИФНγ (активатор макрофагов и NK-клеток), ИЛ-5 (стимулирует пролиферацию В-лимфоцитов, а также индуцирует и активирует эозинофилы); лимфотоксины (активаторы нейтрофилов), в частности лимфотоксин-α (ФНОβ, по новой номенклатуре LTα), обеспечивающий образование воспалительных гранулем in vivo.
Группа 5. Противовоспалительные (иммуносупрессорные) цитоки-
ны. К ним относят ИЛ-10 (продуцируемый макрофагами и ингибирующий макрофаги) и ТФРβ (продуцируемый активированными CD4+ T-лимфоцитами и ингибирующий дальнейшую пролиферацию лимфоцитов). Кроме того, ИЛ-4 и ИЛ-13 – цитокины, ингибирующие макрофаги, а также в некоторых процессах выступающие в качестве противовоспалительных.
В табл. 4-2 приведена краткая характеристика некоторых цитокинов.
Хемокины
Среди цитокинов особое значение для иммуногенеза и модуляции воспаления имеют хемокины – небольшие (66-76 аминокислотных остатков) секреторные белки, регулирующие миграцию лейкоцитов. Кроме того, большинство хемокинов поддерживает ангиогенез и продукцию коллагенов клетками соединительной ткани – регенерацию. В настоящее время известно не менее 50 хемокинов, в том числе многие факторы хемотаксиса моноцитов и ИЛ-8. Считают, что при определённых условиях любая клетка организма продуцирует те или иные хемокины. Эти молекулы способны связываться не только со своими лигандами на мембране клетки-мишени, но и с молекулами межклеточного матрикса, создавая в нём градиент концентрации по мере приближения к клетке-продуценту хемокина.
Эти хемоаттрактанты имеют структурное сходство, в том числе в расположении остатков цистеина, образующих дисульфидные мостики. На основании расположения первых двух цистеиновых остатков выделяют 4 семейства хемокинов: CC, CXC, C и CX3C.
В табл. 4-3 приведена краткая характеристика некоторых известных на сегодняшний день хемокинов.


















Рецепторы для цитокинов и хемокинов
Выделяют несколько семейств рецепторов для цитокинов (рис. 4-4).
• Семейство рецепторов гемопоэтических цитокинов представлено гетеродимерными молекулами и включает рецепторы для ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9 и ИЛ-15; рецептор для GM-CSF; рецептор для эритропоэтина; рецептор для гормона роста. Рецептор для ИЛ-2 существует в трёх формах, различающихся по составу субъединиц, а также по аффинности к ИЛ-2. Тример ИЛ-2Rαβγ обладает наибольшей аффинностью, димер ИЛ-2Rβγ – промежуточной и мономер ИЛ-2Rα – наименьшей (рис. 4-5).
• Семейство рецепторов интерферонов – гомодимерные трансмембранные молекулы. Помимо собственно рецепторов для интерферонов в семейство входит рецептор для ИЛ-10.
• Семейство рецепторов фактора некроза опухоли (TNFR – Tumor Necrosis Factor Receptor) включает молекулы, состоящие из одной трансмембранной полипептидной цепи: TNFR-I и TNFR-II, CD40, Fas (CD95), CD30, CD27, рецептор для фактора роста нервов (NGFR).
Путь проведения сигналов от рецепторов цитокинов (рис. 4-6) – самый короткий из известных, что соответствует физиологическим особенностям эффектов цитокинов (очень быстрые, но непродолжительные).
• Как правило, связывание цитокина с рецептором приводит к его диили тримеризации. Это вызывает конформационные из-

Рис. 4-4. Основные типы цитокиновых рецепторов. Обозначения аминокислотных остатков: С – цистеин, W – триптофан, S – серин, Х – любой остаток

Рис. 4-5. Общие полипептидные цепи цитокиновых рецепторов

Рис. 4-6. Проведение сигналов от рецепторов для цитокинов (схема). Пояснения см. в тексте
менения, передающиеся связанным с полипептидными цепями рецептора тирозинкиназам семейства Janus, способными фосфорилировать их по остатку тирозина. Известно 4 члена этого семейства: Jak1, Jak2, Jak3, Tyk-2. • К фосфорилированным участкам рецептора могут присоединяться молекулы из семейства STAT (Signal Transducers and Activators of Transcription) – проводники сигналов и активаторы транскрипции. Описано 7 молекул STAT: STAT1, STAT2, STAT3, STAT4, STAT5а, STAT5b, STAT6.
– Те же киназы Janus (присоединившиеся к рецептору) фосфорилируют молекулы STAT по остатку тирозина в N-концевом домене.
– Фосфорилированные STAT отделяются от внутриклеточной части рецептора, образуют гомоили гетеродимеры и мигрируют в ядро, где связываются с ДНК и активируют транскрипцию.
Рецепторы для хемокинов принадлежат к семейству интегральных мембранных белков, содержащих семь спиральных доменов, семикратно пронизывающих клеточную мембрану; в это семейство входят также рецепторы для анафилатоксинов комплемента (C5a, C3a, C4a), фоторецепторы (родопсин и бактериородопсин) и множество других. Рецепторы этого семейства передают сигнал внутрь клетки через G-белки (ГТФ/ ГДФ-связывающие белки).
• Каждый G-белок состоит из трёх пептидных цепей – Gα,Gβ иGγ. В покое Gα-цепь образует комплекс с ГДФ. При связывании рецептора с лигандом ГДФ замещается на ГТФ и Gα-цепь диссоциирует от димера Gβ/Gγ (рис. 4-7).

Рис. 4-7. Белок G: 1 – выключенное состояние: α-субъединица связана с гуанозиндифосфатом (ГДФ) и не контактирует с эффектором; 2 – при взаимодействии лиганда с рецептором ГДФ заменяется на ГТФ, G-белок активируется; 3 – G-белок диссоциирует, несущая ГТФ α-субъединица перемещается в мембране, связывается с эффектором и активирует его; 4 – α-субъединица превращает ГТФ в ГДФ, инактивируется и объединяется с другими субъединицами G-белка

Рис. 4-8. Проведение сигналов с рецепторов семейства тетраспанинов. Роль инозиттрифосфата и диацилглицерина в реализации действия лигандов на клеткумишень. Образование комплекса лиганда-рецептор стимулирует G-белок, активирующий фосфолипазу С. Фосфолипаза С катализирует расщепление фосфатидил инозит-4,5-бифосфата (PIP2) на инозит-1,4,5-трифосфат (IP3) и диацилглицерин (DAG). Инозиттрифосфат (IP3) вызывает высвобождение Ca2+ из внутриклеточных депо. Ca2+-зависимая протеинкиназа С, активированная диацилглицерином (DAG), фосфорилирует белки клетки
• Ga-цепи различных G-белков имеют разные функции: одни активируют фосфолипазу Сγ, другие – аденилатциклазу, катализирующую образование циклического аденозинмонофосфата (цАМФ). Это приводит к разнообразным физиологическим эффектам, реализуемым посредством изменения режима функционирования ионных каналов, активации или блокирования разных биохимических реакций (рис. 4-8).
• Кроме того, Gα-цепь обладает ГТФазной активностью, что позволяет ей вновь объединиться с другими субъединицами G-белка и прекратить проведение сигнала.
ИММУННАЯ ПАМЯТЬ
Феномен иммунной памяти проявляется в том, что в случае успешной реализации иммунного ответа на патоген при его повторных попаданиях в организм санация осуществляется существенно быстрее и эффективнее, а патоген не успевает вызвать патологический инфекционный процесс. Это состояние известно как протективный иммунитет, т.е. иммунитет, защищающий от заболевания.
В основе феномена иммунной памяти лежит следующий факт: часть лимфоцитов (единицы процентов) антигенспецифичного клона, вовлечённого в первый иммунный ответ, «замораживается» и циркулирует в организме в течение неопределённого времени (для разных антигенов время очень различается – вплоть до продолжительности жизни всего организма).
В настоящее время неизвестно, какие именно молекулы и взаимодействия и на каком точно этапе иммуногенеза определяют формирование популяции лимфоцитов памяти. В то же время установлены различия лимфоцитов памяти от других субпопуляций тех же лимфоцитов.
• B-лимфоциты. B-лимфоциты памяти отличаются от плазматических клеток (терминальной стадии дифференцировки В-лимфоцитов) по ряду признаков.
– B-лимфоциты памяти несут поверхностные иммуноглобулины, экспрессируют молекулы MHC-II; способны к пролиферации, переключению изотипов иммуноглобулинов, гипермутированию гипервариабельных участков молекулы иммуноглобулина – CDR (Complementarity Determining Region), расположенных в V-домене (см. главу 5), но не способны к интенсивному образованию иммуноглобулинов. B-лимфоциты памяти находятся в покоящемся (неактивированном) состоянии.
– Плазматические клетки, напротив, способны к интенсивному синтезу/секреции иммуноглобулинов, но не несут поверхностные иммуноглобулины, не экспрессируют молекулы MHC-II; не способны к пролиферации, переключению между изотипами иммуноглобулинов, гипермутированию CDR V-доменов иммуноглобулинов.
• T-лимфоциты памяти отличаются от зрелых T-клеток и по частоте встречаемости антигенспецифичных клонов в лимфоидной ткани, и по экспрессии ряда мембранных молекул [LFA-3 (CD58); CD2; LFA-1 (CD11a/CD18); CD44; CD45RO] более чем в 10-100 раз. В отличие от наивных лимфоцитов, Т-клетки памяти испытывают
существенно меньшую потребность в медиаторах воспаления и в костимулирующих сигналах для запуска иммунного ответа на специфический антиген и могут отвечать при минимальных симптомах воспаления или даже при их отсутствии. В то же время наивные T-клетки, в отличие от T-лимфоцитов памяти, экспрессируют на поверхности CD45RA и большие количества молекул L-селектина, обеспечивающие хоминг Т-лимфоцитов в лимфатические узлы.
Вакцины
Целью вакцинации является индукция образования клеток памяти, специфичных к возбудителю. Это достигается посредством активации врождённого иммунитета и клонов В- и/или Т-клеточного звена адаптивного иммунитета. Основные проблемы вакцинации состоят в обеспечении безвредности вакцинного препарата при сохранении его иммуногенности. Тенденция заменить природные препараты антигенов (убитые, ослабленные патогены, экстракты активных субстанций) синтетическими препаратами или кодирующими их генами наталкивается на проблемы, связанные с недостаточной силой иммунного сигнала. Разновидности вакцин представлены на рис. 4-9.

Рис. 4-9. Разновидности вакцин
АНТИГЕН
Антиген – любая молекула (соединения разной химической природы: пептиды, углеводы, полифосфаты, стероиды), которая потенциально может быть распознана иммунной системой организма как чужеродная («не своя»). Таким образом, антиген – молекула, несущая признаки генетически чужеродной информации. В качестве синонима применяют также термин «иммуноген», подразумевая, что иммуноген (антиген) способен вызвать ответные реакции иммунной системы, в итоге приводящие к развитию приобретённого иммунитета. Способность вызывать такие ответные реакции (т.е. образование антител и сенсибилизацию – приобретение организмом чувствительности к антигену) присуща не всей молекуле антигена, а только особой её части, которую называют антигенной детерминантой, или эпитопом. У большинства белковых антигенов такую детерминанту образует последовательность из 4-8 аминокислотных остатков, а у полисахаридных антигенов – 3-6 гексозных остатков. Число детерминант у одного вещества может быть различным. Так, у яичного альбумина их не менее 5, у дифтерийного токсина – минимум 80, у тиреоглобулина – более 40. Различают экзогенные (поступающие в организм извне) и эндогенные антигены (аутоантигены – продукты собственных клеток организма), а также антигены, вызывающие аллергические реакции, – аллергены. О разновидностях антигенов см. ниже (Т-зависимые и Т-независимые антигены, суперантигены).
АНТИТЕЛА
Антитело – особый растворимый белок с определённой биохимической структурой – иммуноглобулин, который присутствует в сыворотке крови и других биологических жидкостях и предназначен для связывания антигена. В энциклопедическом словаре медицинских терминов
указано следующее определение: антитела («анти» + «тела») – глобулины сыворотки крови человека и животных, образующиеся в ответ на попадание в организм различных антигенов (принадлежащих бактериям, вирусам, белковым токсинам и др.) и специфически взаимодействующие с этими антигенами.
• Антитела связывают антиген. Существенным и уникальным свойством антител, отличающим их даже от TCR, служит их способность связывать антиген непосредственно в том виде, в каком он проникает в организм (в нативной конформации). При этом времени на предварительную метаболическую обработку антигена не требуется, поэтому антитела – очень важный фактор безотлагательной защиты организма (например, от сильных ядов, при укусах змей, скорпионов, пчёл и др.).
• Антитела конкретной специфичности синтезируются исключительно B-лимфоцитами одного клона. При дифференцировке каждый B-лимфоцит и его дочерние клетки (клон B-лимфоцитов) приобретают способность синтезировать единственный вариант антител с уникальной структурой антигенсвязывающего центра молекулы, т.е. имеет место клональность биосинтеза иммуноглобулинов.
• Множество антител. В то же время вся совокупность B-лимфоцитов организма способна синтезировать огромное разнообразие антител – около 106-109. Однако точно установить, сколько разных антигенов потенциально способно связать одно антитело, принципиально невозможно.
• Иммуноглобулины. Антитела – белки, имеющие глобулярную вторичную структуру, поэтому молекулы этого типа и названы иммуноглобулинами. Антитела принадлежат к суперсемейству иммуноглобулинов (рис. 5-1), куда входят также белки MHC, некоторые молекулы адгезии [LFA-2 (CD2), ICAM-1 (CD54), VCAM-1 (CD106) и др. (см. табл. 4-1)], TCR, отдельные рецепторы цитокинов [для ИЛ-1 типов I и II, ИЛ-6, M-CSF, c-kit (CD117)], рецепторы для Fc-фрагментов иммуноглобулинов (FcaR, FcyRI, FcyRII), мембранные молекулы CD3, CD4, CD8, CD80 и др.

Рис. 5-1. Структура белков суперсемейства иммуноглобулинов: а – молекула MHC-I состоит из α-цепи, внемембранная её часть связана с короткой цепью β2-микроглобулина; б – молекула MHC-II состоит из двух субъединиц: более длинной α-цепи и β-цепи. Часть каждой цепи выступает над поверхностью клеточной мембраны, цепь содержит трансмембранный участок и небольшой фрагмент в цитоплазме; в – антигенсвязывающая область молекулы TCR состоит из двух цепей: α и β. Каждая цепь представлена двумя внеклеточными иммуноглобулинподобными доменами (вариабельным на NH-конце и константным), стабилизированными при помощи S-S-связей, и цитоплазматическим стабильным COOH-концом. SH-группа, присутствующая в цитоплазматическом фрагменте α-цепи, может взаимодействовать с мембранными или цитоплазматическими белками; г – мономер молекулы IgM, встроенный в плазматическую мембрану B-лимфоцитов, это рецептор для антигена. Разнообразие специфичностей TCR и иммуноглобулинов обеспечивается возможностью сайтспецифичной рекомбинации множества различных генных сегментов, кодирующих отдельные фрагменты молекулы
ИММУНОГЛОБУЛИНЫ
Иммуноглобулины [международная аббревиатура – Ig (Immunoglobulin)] – класс структурно связанных белков, содержащих 2 вида парных полипептидных цепей: лёгкие (L, от англ. Light – лёгкий), с низкой молекулярной массой, и тяжёлые (H, от англ. Heavy – тяжёлый), с высокой молекулярной массой. Все 4 цепи соединены вместе дисульфидными

Рис. 5-2. Молекула иммуноглобулина. Обозначения: L – лёгкие цепи; H – тяжёлые цепи; V – вариабельная область; С – константная область. N-концевые области L- и Н-цепей (V-область) образуют 2 антигенсвязывающих центра – (Fab)2-фрагмент. Fc-фрагмент молекулы взаимодействует со своим рецептором на мембране различных типов клеток (макрофаги, нейтрофилы, тучные клетки)
связями. Принципиальная схема строения молекулы иммуноглобулина (мономер) приведена на рис. 5-2.
Классы иммуноглобулинов
На основании структурных и антигенных признаков Н-цепей иммуноглобулины подразделяют (в порядке относительного содержания в сыворотке крови) на 5 классов: IgG (80%), IgA (15%), IgM (10%), IgD (менее 0,1%), IgE (менее 0,01%). Заглавная латинская буква справа от «Ig» обозначает класс иммуноглобулина – М, G, А, Е или D. Молекулы IgG, IgD и IgE – мономеры, IgM – пентамер; молекулы IgA в сыворотке крови – мономеры, а в экскретируемых жидкостях (слёзная, слюна, секреты слизистых оболочек) – димеры (рис. 5-3).

Рис. 5-3. Мономеры и полимеры иммуноглобулинов. J-цепь (от англ. joining – связывающая) связывает остатки цистеина на C-концах тяжёлых цепей IgM и IgA
• Подклассы. У человека иммуноглобулины классов G (IgG) и A (IgA)
имеют несколько подклассов: IgG1, IgG2, IgG3, IgG4 и IgA1, IgA2.
• Изотипы. Классы и подклассы иммуноглобулинов иначе называют изотипами (приставка «изо» означает то, что у всех представителей данного вида они одинаковы).
• Аллотипы. Индивидуальные аллельные варианты иммуноглобулинов в пределах одного изотипа называются аллотипами.
• Идиотипы. Идиотипические детерминанты находятся в активных центрах (антигенсвязывающих участках) антител, т.е. соединены с V-доменами, и служат маркёрами индивидуальньгх антител.
Данные о классах и подклассах иммуноглобулинов суммированы в табл. 5-1.

Структура иммуноглобулинов
• Фрагменты молекулы иммуноглобулина (см. рис. 5-2). Путём протеолитического расщепления папаином молекулы иммуноглобулина с последующей ионообменной хроматографией можно получить 3 фрагмента: 1 Fс-фрагмент и 2 Fab-фрагмента.
– Fab-фрагменты (Fragment, antigen binding – антигенсвязывающие фрагменты) – 2 одинаковых фрагмента, сохраняющих способность связывать антиген.
– Fc-фрагмент (Fragment crystallizable – кристаллизующийся фрагмент) – непарный, легко кристаллизуется. Fс-фрагменты иммуноглобулинов в пределах одного изотипа строго идентичны (независимо от специфичности антител). Они обеспечивают взаимодействие самих антител и комплексов антиген-антитело с системой комплемента, фагоцитами, эозинофилами, базофилами, тучными клетками. При этом каждый класс иммуноглобулинов взаимодействует только с определёнными эффекторными клетками или молекулами.
• Тяжёлые цепи определяют различия между классами иммуноглобулинов, поэтому разные типы тяжёлых цепей обозначают греческими буквами соответственно латинской аббревиатуре класса: для IgM – μ, для IgG – γ, для IgA – α, для IgE – ε, для IgD – δ. Каждая из H-цепей молекул IgG, IgD и IgA состоит из 4 доменов (см. рис. 5-2): вариабельного – VH и константных (CH1, CH2, CH3). H-цепи молекул IgM и IgE содержат дополнительный домен – СН4.
• Лёгкие цепи примыкают к N-концу тяжёлых цепей. Каждая L-цепь состоит из двух доменов – VL и CL. Известно 2 типа лёгких цепей иммуноглобулинов – κ и λ. Функциональные различия между иммуноглобулинами с лёгкими κ- или λ-цепями не выявлены.
• Домены. Вторичная структура полипептидных цепей представлена доменами (см. рис. 5-1), каждый из которых включает около 110 аминокислотных остатков.
– V-домены обеих цепей имеют сильно варьирующий аминокислотный состав (отсюда и их обозначение – Variable), что позволяет им связывать разные антигены.
◊ Гипервариабельные участки. Внутри V-доменов выделяют несколько гипервариабельных участков: CDR1, CDR2, CDR3 (CDR – от Complementarity Determining Region), т.е. области молекулы иммуноглобулина, определяющие её комплементарность антигену.
◊ Каркасные области. Промежутки между гипервариабельными участками обозначают как FWR (FrameWork Regions), т.е. каркасные области: FWR1, FWR2, FWR3 и FWR4. Помимо чисто «скелетной» для них характерны и другие функции, не связанные с распознаванием антигенов: FWR-участки V-области молекул иммуноглобулинов могут обладать ферментативной (протеазной и нуклеазной) активностью, связывать ионы металлов и суперантигены.
– C-домены. Остальные домены имеют строго инвариантный для каждого изотипа иммуноглобулинов аминокислотный состав и называются C-доменами (от Constant).
◊ В C-доменах и в FWR-участках V-доменов содержатся одинаковые аминокислотные последовательности, что рассматривают как молекулярное свидетельство их генетической общности.
◊ Гомологичные последовательности аминокислот присутствуют (помимо иммуноглобулинов) и в молекулах других белков, объединяемых с иммуноглобулинами в одно молекулярное суперсемейство иммуноглобулинов (см. выше и рис. 5-1).
Большое число возможных комбинаций L- и H-цепей создаёт многообразие антител каждого индивидуума.
• Формы иммуноглобулинов. Молекулы иммуноглобулинов одной и
той же специфичности присутствуют в организме в трёх формах:
растворимой, трансмембранной и связанной.
– Растворимая. В крови и других биологических жидкостях – секретируемый клеткой иммуноглобулин.
– Трансмембранная. На мембране B-лимфоцита в составе антигенраспознающего рецептора – BCR (B-Cell Receptor). Трансмембранные формы всех классов иммуноглобулинов (включая IgM и IgA) – мономеры.
– Связанная. Иммуноглобулины, за Fc-конец связанные с рецепторами клеток (макрофагами, нейтрофилами, эозинофилами и тучными). Все антитела, кроме IgE, могут фиксироваться рецепторами FcR клеток только в комплексе с антигеном.
Связывание антигена
Гипервариабельные участки V-области антитела (как и TCR) непосредственно и комплементарно связывают антиген с помощью ионных,
ван-дер-ваальсовых, водородных и гидрофобных взаимодействий (сил, связей).
• Эпитоп (антигенная детерминанта – см. выше) – участок молекулы антигена, непосредственно участвующий в образовании ионных, водородных, ван-дер-ваальсовых и гидрофобных связей с активным центром Fab-фрагмента.
• Сродство между антигеном и антителом количественно характеризуют понятиями «аффинность» и «авидность».
• Аффинность. Силу химической связи одного антигенного эпитопа с одним из активных центров молекулы иммуноглобулина называют аффинностью связи антитела с антигеном. Аффинность количественно принято оценивать по константе диссоциации (в моль-1) одного антигенного эпитопа с одним активным центром.
Так как у цельных молекул мономерных иммуноглобулинов присутствует по 2 потенциально равнозначных симметрично расположенных активных центра для связывания антигена, у димерного IgA – 4, а у пентамерного IgM – 10 (10 для гаптенов, а для большинства антигенов всего лишь 5), скорость диссоциации целой молекулы иммуноглобулина со всеми связанными эпитопами меньше, чем скорость диссоциации одного из активных центров.
• Авидность. Силу связи целой молекулы антитела со всеми антигенными эпитопами, которые ей удалось связать, называют авидностью связи антитела с антигеном.
ГЕНЫ ИММУНОГЛОБУЛИНОВ
Зародышевые гены иммуноглобулинов. У здорового человека В-лимфоциты в течение жизни создают несколько миллионов вариантов антител, связывающих разные антигены (потенциально 1016 антигенов). Никакой геном физически не несёт столько различных структурных генов. Количество наследуемого от родителей генетического материала (ДНК), определяющего биосинтез антител, не так уж и велико – немногим более 120 структурных генов. Это наследуемое множество генов – зародышевые гены иммуноглобулинов (зародышевая конфигурация генов).
Гены вариабельных доменов
Во всех соматических клетках, включая СКК, гены иммуноглобулинов находятся именно в зародышевой конфигурации, где гены
V-участков представлены в виде отдельных сегментов, расположенных друг относительно друга на значительном расстоянии и сгруппированных в несколько кластеров: собственно V (вариабельный), J (связующий), а у тяжёлых цепей также D (от англ. Diversity – разнообразие). Формирование разнообразия генов для миллионов вариантов V-участков молекул иммуноглобулинов продолжается в течение всей жизни. Оно происходит в процессе дифференцировки B-лимфоцитов и является запрограммированно случайным. В его основе лежат сразу несколько механизмов, свойственных только генам антигенсвязывающих молекул (иммуноглобулин, TCR): рекомбинация зародышевых сегментов, неточность связей между V-, D- и J-сегментами, соматический гипермутагенез, комбинаторика тяжёлых и лёгких цепей в случае В-лимфоцитов или разных цепей TCR. Характеристика V-генов антигенраспознающих структур человека представлена на рис. 5-4.

Рис. 5-4. Характеристика V-генов антигенраспознающих структур человека. Представлены основные характеристики семи известных типов вариабельных генов, определяющих формирование антигенраспознающих структур лимфоцитов. В строке «Вариабельный (V)» указано число зародышевых V-генов соответствующих типов; в скобках отмечено число функционирующих генов (остальные – псевдогены). В соответствующих строках выделено число сегментов D (где они есть) и J, участвующих в формировании зрелого V-гена. Указан размер участка на соответствующих хромосомах, занимаемый сегментами, из которых в процессе реаранжировки формируется зрелый V-ген
• Соматическая рекомбинация. На самом раннем этапе дифференцировки лимфоцитов начинается сложный генетический процесс объединения сегментов ДНК, кодирующих разные части антигенсвязывающих молекул – V- и C-домены. В непрерывную последовательность ДНК соединяются по одному сегменту из V-, D- и J-областей, при этом в каждом отдельном B-лимфоците возникает уникальная комбинация VDJ для тяжёлой цепи и VJ – для лёгкой. ДНК из промежутков, содержащих незадействованные зародышевые гены, выбрасывается из генома в виде кольцевых структур.
– Число возможных комбинаций можно подсчитать. Для к-цепи из 35 V-сегментов и 5 J-сегментов может получиться 35×5=175 вариантов V-области; для λ-цепи – 32×4=128 вариантов; всего для лёгких цепей 303 варианта; для тяжёлой цепи 45Vx23Dx6J=6210 вариантов антигенсвязывающих областей. В целой молекуле иммуноглобулина разные лёгкие и тяжёлые цепи объединяются в тетрамер также случайным образом (по крайней мере, теоретически). Число случайных сочетаний из 303 и 6210 – около 1,9×106.
– Рекомбиназы. Рекомбинацию ДНК генов иммуноглобулинов катализируют специальные ферменты – рекомбиназы RAG-1 и RAG-2 (Recombinase Activation Gene – активирующий рекомбинацию ген). Они же катализируют рекомбинацию ДНК генов TCR в T-лимфоцитах, т.е. рекомбиназы – уникальные ферменты лимфоцитов. Однако в B-лимфоцитах эти ферменты не «трогают» гены TCR, а в T-лимфоцитах «обходят» гены иммуноглобулинов. Следовательно, до начала процесса перестройки ДНК в клетке уже существуют регуляторные белки, различные у T- и B-лимфоцитов.
Рекомбинационный комплекс представлен на рис. 5-5.
Сигналом к перестройке V-генов антигенраспознающих рецепторов В- и Т-клеток служит экспрессия генов рекомбинационного комплекса, обеспечивающего основные события на уровне перестраиваемых V-генов и прилегающих генетических сегментов. Комплекс включает ферменты, катализирующие одно- и двунитевые разрывы ДНК, их сшивание, нематричную достройку свободных концов нитей ДНК, а также белки, способствующие сближению пространственно разъединённых фрагментов ДНК. Включение экспрессии генов рекомбинационного комплекса обусловлено действием дифференцировочных факторов.

Рис. 5-5. Рекомбинационный комплекс
Процесс реаранжировки начинается с экспрессии рекомбиназ RAG-1 и RAG-2. Рекомбиназы присоединяются рядом с сегментами, которым предстоит войти в состав зрелого V-гена. Затем они димеризуются, что приводит к формированию петли. После этого происходят разрывы двунитевой ДНК между сайтом связывания фермента и соответствующим сегментом. Свободные концы нитей сшиваются при участии ДНК-лигазы IV с образованием шпильки. Затем под влиянием эндонуклеазы Artemis происходит повторный разрыв нити ДНК в шпильке и попарное воссоединение (лигирование) нитей двуспиральной ДНК как в сегментах, которые войдут в состав зрелого V-гена (информационная последовательность), так и в удаляемом участке (сигнальная последовательность). Это становится возможным благодаря «подтягиванию» друг к другу ранее разъединённых участков ДНК, которое происходит с участием димера Ku70/Ku86 (Ku86 также называют Ku80). Этот процесс («разрешение» шпильки) происходит с участием ДНК-зависимой протеинкиназы DNA-PKcs. В результате формируется зрелый V-ген и сигнальное кольцо (рис. 5-6, 5-7).
Реаранжировка V-генов антигенраспознающих структур сопровождается сближением генетических сегментов. Этот процесс обеспечивается определённой организацией пространства между V-генами и

Рис. 5-6. Роль рекомбиназ RAG-1 и RAG-2 в начальных событиях перестройки V-генов
генетическими сегментами (J, D). Справа (с З’-конца) ко всем V-генам примыкают три участка ДНК со строго детерминированной последовательностью: гептамер (состава 5’CACAGTG3′), спейсер, состоящий из 23 пар оснований, и нонамер (состава 5’ACAAAAACC3′). К J-сегменту слева (с 5′-конца) примыкает гептамер, далее (влево) следует спейсер, содержащий 12 пар оснований, и нонамер. В случае генов, кодирующих Н- и λ-цепи, к гептамеру при V-гене примыкает спейсер, содержащий 23 пары оснований, а к гептамеру соединительных сегментов (J в случае λ-цепи, D в случае Н-цепи) – спейсер, содержащий 12 пар оснований. Для гена к-цепи характерно противоположное расположение 23- и 12-членных спейсеров, отражающих последовательности сегментов: для к-цепи – 7-12-9 – 9-23-7, для λ-цепи – 7-23-9 – 9-12-7. В случае генов Н-цепи ситуация усложняется наличием трёх генов/сегментов, подлежащих соединению (V-D-J). В этом случае цифровое правило принимает вид: 7-23-9 – 9-12-7 – 7-12-9 – 9-23-7. На
рис. 5-6 воспроизведена перестройка гена λ-цепи. При формировании петли гептамеры, прилегающие к V-гену и соединительным сегментам, узнают друг друга и взаимодействуют по принципу комплементарности, поскольку они представляют палиндромы, т.е. последовательности, читаемые от З’-конца и от 5′-конца, комплементарные друг другу, например CACAGTG и GTGACAC. То же можно сказать и о нонамерах. В результате такого взаимодействия сегменты, которые не войдут в состав зрелого V-гена, включаются в петлю и удаляются в составе сигнального кольца, а избранные V- и J-сегменты оказываются сближенными и образуют зрелый V-ген.
• Неточность связи V-D-J. Под неточностью связей сегментов V, D и J понимают тот факт, что при их формировании происходит добавление лишних нуклеотидов. Выделяют 2 типа таких нуклеотидов: P- и N-нуклеотиды.
– Нуклеотиды P (от англ. Palindromic sequences – зеркальные последовательности) возникают на концах каждого из сегментов, вовлечённых в рекомбинацию, при вырезании одноцепочечных

Рис. 5-7. Образование P- и N-вставок при реаранжировке V-генов
петель ДНК (шпилек) и «достройке хвостов» ферментами репарации ДНК.
– Нуклеотиды N (от англ. Nontemplate-encoded – нематрично кодируемые), характерны только для тяжёлых цепей, случайным образом пристраиваются к концам V-, D- и J-сегментов специальным ферментом – терминальной дезоксинуклеотидилтрансферазой (TdT).
– С учётом присоединения N- и P-нуклеотидов число вариантов антигенсвязывающих областей целых молекул иммуноглобулинов составляет порядка 1013. Если учесть аллельные варианты V-, D- и J-сегментов, то теоретически разнообразие составит около 1016 (в действительности это значение меньше, поскольку в организме нет такого числа лимфоцитов).
– В 2/3 случаев «платой» за попытки увеличить разнообразие антигенсвязывающих областей антител служит непродуктивная рекомбинация генов, т.е. сдвиг рамки считывания или генерация стоп-кодонов, делающие невозможной трансляцию белка.
• Гипермутагенез – запланированное повышение частоты точечных мутаций – отличает гены иммуноглобулинов даже от генов TCR. Гипермутагенез происходит только в В-лимфоцитах во время иммуногенеза (т.е. после состоявшегося распознавания антигена и начавшегося иммунного ответа) в зародышевых центрах лимфоидных фолликулов периферических лимфоидных органов и тканей (лимфатических узлов, селёзенки, диффузных скоплений). Частота точечных мутаций в V-генах иммуноглобулинов достигает 1-го нуклеотида из 1000 на 1 митоз (т.е. каждый второй В-лимфоцит клона в зародышевом центре приобретает точечную мутацию в V-гене иммуноглобулинов), тогда как для всей остальной ДНК она на 9 порядков ниже.
Гены константных доменов
Структурные гены константных доменов полипептидных цепей иммуноглобулинов расположены в тех же хромосомах, что и V-, D- и J-гены, к 3′-концу от J-сегментов.
• Лёгкая цепь (рис. 5-8). Для лёгких к-цепей существует один C-ген – Ск, а для λ-цепей (на рисунке не показаны) – 4 или 5 (в зависимости от гаплотипа) – Сλ1,2,3,6,7. «Стыковка» нуклеотидного кода для V- и C-доменов лёгких цепей происходит на уровне не ДНК, а РНК – по механизму сплайсинга первичного транскрипта РНК.

Рис. 5-8. Структура генов и синтез белка κ-лёгкой (L) цепи иммуноглобулинов человека
• Тяжёлая цепь (рис. 5-9) каждого изотипа иммуноглобулинов также кодируется отдельным C-геном. У человека такие гены расположены в следующем порядке, считая от J-сегмента к З’-концу: Сμ, Сδ, СγЗ, Сγ1, ψСε (псевдоген ε-цепи), Cα1, Cγ2, Cγ4, Сε, Сα2. Завершившие лимфопоэз B-лимфоциты, независимо от специфичности их BCR, экспрессируют иммуноглобулины только классов IgM и IgD. При этом мРНК транскрибируется в виде непрерывного первич-

Рис. 5-9. Структура генов тяжёлой (Н) цепи иммуноглобулинов человека
ного транскрипта с перестроенных генов VDJ и Сμ/Cδ. ДНК C-генов других изотипов остаётся нетронутой. В результате альтернативного сплайсинга первичного транскрипта образуются мРНК отдельно для тяжёлых цепей IgM и IgD, которые и транслируются в белок. Этим процессом заканчивается полноценный лимфопоэз B-клеток.
Переключение изотипов иммуноглобулинов
В процессе развития иммунного ответа, т.е. после распознавания антигена и под действием определённых цитокинов и молекул клеточной мембраны T-лимфоцитов, может происходить переключение синтеза иммуноглобулинов на другие изотипы – IgG, IgE, IgA (рис. 5-10).
• Переключение изотипа тяжёлой цепи тоже идёт по механизму рекомбинации ДНК: к ранее перестроенной комбинации VDJ присоединяется один из C-генов тяжёлой цепи (либо Сγ1, либо Сγ2, либо Сγ3, либо Сγ4, либо Сε, либо Сα1, либо Сα2). При этом происходит разрыв ДНК по областям переключения – SR (Switch Region), расположенным в интронах перед каждым C-геном (за исключением Сδ).
• ДНК C-генов, предшествующих задействованному (расположенных на 5′-конце от него), элиминируется в виде кольцевых структур, поэтому дальнейшее переключение изотипа возможно только по направлению к 3′-концу.
• Установлено, что гипермутагенез и переключение изотипов иммуноглобулинов катализируются ферментом AID (Activation Induced Cytidine Deaminase – цитидиндезаминаза, индуцируемая активацией). Этот фермент специфически атакует экспрессированные гены иммуноглобулинов и отщепляет аминогруппы от цитидиновых оснований, которыми богата ДНК этих генов. В результате этого цитозины преобразуются в урацилы, которые распознаются и вырезаются ферментами репарации ДНК. Последующая цепочка каталитических реакций с участием более чем десяти различных белков (эндонуклеаз, фосфатаз, полимераз, гистонов и т.п.) приво-

Рис. 5-10. Рекомбинация ДНК при переключении изотипов иммуноглобулинов B-лимфоцитов
дит к появлению мутаций (в случае гипермутагенеза) или двуцепочечных разрывов ДНК по областям переключения изотипов.
B-ЛИМФОЦИТЫ
В-клеточный рецептор (BCR)
Молекула иммуноглобулина способна связывать антиген как в растворе, так и в иммобилизованном на клетке состоянии, однако для формирования полноценного антигенраспознающего рецептора (BCR) необходимы ещё 2 полипептида, называемые Igα (CD79a) и Igβ (CD79b). Все 6 полипептидных цепей BCR представлены на рис. 5-11.
Внеклеточный домен. Igα и Igβ имеют по одному внеклеточному домену, которым они прочно, но нековалентно связаны с тяжёлыми цепями иммуноглобулинового компонента BCR.

Рис. 5-11. Схема строения В-клеточного рецептора и связанных с ним молекул
Цитоплазматические активирующие последовательности. В цитоплазматических участках Igα и Igβ присутствуют характерные последовательности аминокислотных остатков, называемые иммунорецепторными тирозинсодержащими активирующими последовательностями (ITAM – Immunoreceptor Tyrosine-based Activation Motif); такие же последовательности присутствуют в проводящих сигнал компонентах антигенраспознающего рецептора T-клеток.
Активация B-лимфоцита. Пролиферацияидифференцировка В-лимфоцита может запускаться непосредственно связыванием антигена с BCR. Однако для эффективной активации только через BCR необходима
перекрёстная «сшивка» антигеном нескольких BCR. Для этого молекула антигена должна иметь повторяющиеся эпитопы на своей поверхности. В большинстве же случаев для активации В-клетки недостаточно сигнала, поступающего только от BCR, – требуется так называемый второй сигнал, поставляемый активированным Т-хелпером через корецепторы.
Корецепторный комплекс
В дополнительный корецепторный комплекс мембранных молекул, связанных с внутриклеточными системами проведения сигналов, входят, по крайней мере, 3 мембранные молекулы: CD19, CR2 (CD21) и TAPA-1 (CD81).
• CR2 – рецептор для компонентов комплемента. Связывание CR2 с продуктами деградации компонентов комплемента (C3b, C3dg и C3bi), опсонизировавших антиген, вызывает фосфорилирование молекулы CD19, которая в активированном состоянии ассоциирована с Src киназой Lyn.
• CD19. Фосфорилированная молекула CD19 активирует фосфатидилинозит-3-киназу (PI3K) и молекулу Vav (многофункциональная молекула проведения внутриклеточных сигналов), которые усиливают активационные реакции, инициированные BCR (см. рис. 5-11).
• TAPA-1 (Target of Antiproliferative Antibody – мишень для антипролиферативных антител) принадлежит к семейству тетраспанинов и в мембране физически примыкает к CD19 и CR2, однако детально роль этой молекулы еще не изучена.
Активация BCR запускает целый ряд каскадов, потенциирование которых зависит от получения дополнительных сигналов с рецепторов цитокинов, TLR и др. Первым шагом является активация тирозин-киназ Lyn, Fyn и Blk (принадлежат к семейству Src-киназ, Fyn и Blk на рисунке не показаны, поскольку они дублируют функции Lyn), а также тирозинкиназ Syk и Btk.
Дальнейшие события проведения сигнала с BCR показаны на рис. 5-11. Сигнальные каскады, идущие от антигенраспознающих рецепторов, более подробно описаны в главе 6 на примере TCR.
Дифференцировка B-лимфоцитов
Дифференцировка B-лимфоцитов из общей лимфоидной клеткипредшественника (потомка СКК) включает несколько этапов и процес-
сов: перестройку генов иммуноглобулинов и интеграцию их продуктов в клеточный метаболизм; экспрессию генов молекул, обеспечивающих проведение сигнала с BCR внутрь клетки; экспрессию генов мембранных молекул, необходимых для взаимодействия с другими клетками (в первую очередь с T-лимфоцитами и ФДК); экспрессию на мембране корецепторных комплексов.
Выделяют 3 главные субпопуляции В-лимфоцитов – В1-, В2(именно эти клетки мы привыкли называть собственно В-лимфоцитами) и В-клетки маргинальной зоны (Marginal Zone B, сокращенно MZB) (рис. 5-12). В1-клетки разделяют на подклассы В1а (CD5+) и B1b (CD5-), сходные по своим свойствам. На рис. 5-13 указаны дифференцировочные факторы, контролирующие развитие субпопуляций В-клеток, и приведены их основные отличительные свойства. В1-клетки и В-клетки маргинальной зоны участвуют в формировании первой линии иммун-

Рис. 5-12. Субпопуляции В-лимфоцитов

Рис. 5-13. Развитие В-лимфоцитов. Обозначения: DHJH, VHDHJH – стадии перестройки VH-гена BCR; VLJL – перестройка VL-гена BCR
ной защиты и служат переходным звеном от врождённого к адаптивному иммунитету. В2-клетки относятся к подсистеме адаптивного иммунитета, являясь основными клетками гуморального иммунного ответа.
B2-лимфоциты
Этапы В2-лимфопоэза. В зависимости от состояния V-генов иммуноглобулинов и варианта экспрессии антигенраспознающего рецептора BCR выделяют несколько стадий дифференцировки В-клеток. На схеме отражены изменения наиболее важных ядерных и мембранных молекул в процессе созревания В-лимфоцитов, а также ростовые факторы, определяющие их пролиферацию. Данные получены при изучении В2лимфоцитов, однако в основных чертах они справедливы также для В1и MZВ-клеток.
В лимфопоэзе B2-лимфоцитов выделяют 6 этапов: общая лимфоидная клетка-предшественник→ранняя про-B-клетка→поздняя проB-клетка → большая пре-B-клетка → малая пре-B-клетка → незрелая B-клетка → зрелая наивная B-клетка (выходит из костного мозга). • Общая лимфоидная клетка-предшественник (ОЛП или CLP – common lymphoid progenitor). Экспрессирует несколько молекул адгезии, обеспечивающих её удержание в течение необходимого периода времени в костном мозге, среди них VLA-4 (Very Late Activation Antigen-4 – очень поздний активационный антиген 4), лигандом
которого на клетках стромы служит VCAM-1 (Vascular Cell Adhesion Molecule – молекула адгезии к стенке сосуда).
• Ранняя про-B-клетка (ПроBI, см. рис. 5-13). Происходит D-Jрекомбинация в генах тяжёлых цепей, на обеих гомологичных хромосомах. В этой стадии, помимо молекул адгезии, экспрессируется рецептор c-Kit (CD117) для первого фактора роста – мембранной молекулы клеток стромы SCF (Stem Cell Factor) – фактора стволовых клеток. Это взаимодействие обеспечивает прохождение предшественниками B-лимфоцитов, ещё не поделёнными на клоны по антигенраспознающим рецепторам, необходимого числа митозов.
• Поздняя про-B-клетка (ПроВII, см. рис. 5-13). Происходит V-DJрекомбинация генов иммуноглобулинов. Сначала этот процесс затрагивает одну из гомологичных хромосом. Если она окажется непродуктивной, то рекомбинация повторяется на второй гомологичной хромосоме. Если перестройка на первой хромосоме продуктивна, вторая хромосома использована не будет. При этом происходит так называемое аллельное исключение (allelic exclusion), когда белок иммуноглобулина будет кодироваться только одной хромосомой, а вторая будет «молчащей». В результате индивидуальный лимфоцит сможет продуцировать антитела только одной специфичности. Этот процесс закладывает основу клональности антител.
– Как только в клетке происходит трансляция полипептида тяжёлой цепи, он экспрессируется на мембране в составе так называемого пре-B-рецептора. Этот рецептор содержит суррогатную лёгкую цепь (идентичную для всех клеток на этой стадии созревания), μ-цепь, Igα, Igβ. Экспрессия этого рецептора транзиторна, но абсолютно необходима для правильной дифференцировки B-лимфоцитов.
– Поздняя про-B-клетка также экспрессирует рецепторы для цитокинов ИЛ-7 и SDF-1, секретируемых клетками стромы и вызывающих пролиферацию и накопление «полуклонов» B-лимфоцитов (про-B- и больших пре-B-клеток) с уже известной специфичностью по тяжёлой цепи, но ещё неизвестной – по лёгкой. Это тоже увеличивает разнообразие молекул иммуноглобулинов: с одной и той же тяжёлой цепью будет сочетаться больше разных вариантов лёгких цепей.
• Пре-B-клетка. Выделяют две популяции пре-В клеток: Пре ВI (или большая пре-В) и ПреВII (или малая пре-В). На этой стадии про-
исходит V-J-перестройка генов иммуноглобулинов лёгких цепей (сначала одной из цепей – κ или λ) на одной из гомологичных хромосом. Если продуктивная перестройка с первой попытки не получается, предпринимаются следующие. Клетки, в которых не произошло ни одной продуктивной перестройки в генах тяжёлых и лёгких цепей, погибают по механизму апоптоза – явления, весьма распространённого среди лимфоцитов (подробнее в главе 9).
• Незрелый B-лимфоцит. Уже экспрессируется дефинитивный BCR, содержащий L-цепь, μ-цепь, а также Igα и Igβ.
Развитие толерантности. На стадии незрелых B-лимфоцитов начинается также развитие толерантности к собственным тканям организма. Для этого предусмотрено 3 механизма: делеция аутореактивных клонов, ареактивность (анергия) и «редактирование» рецептора по антигенной специфичности. Первые два механизма продолжают действовать и по выходе лимфоцита из костного мозга, т.е. при контакте со значительными количествами аутоантигенов.
• Негативная селекция и делеция клонов. Связывание мембранного антигена незрелой B-клеткой (экспрессирует IgM-BCR, но ещё отсутствует IgD-BCR) служит сигналом для её апоптоза. Таким образом, удаляются B-лимфоциты, несущие антигенраспознающие рецепторы, способные связывать белки собственных тканей.
• Ареактивность. Связывание незрелым B-лимфоцитом растворимого антигена не приводит к апоптозу, но лимфоцит приходит в состояние анергии, т.е. проведение сигнала от BCR блокируется и лимфоцит не активируется.
• «Редактирование» рецепторов происходит в небольшой части незрелых B-клеток, в которых ещё активны рекомбиназы RAG-1 и RAG-2. В этих клетках связывание IgM (в составе BCR на поверхности незрелого B-лимфоцита) с антигеном служит сигналом для запуска повторного процесса рекомбинации VDJ/VJ: образующаяся при этом новая комбинация может не быть аутореактивной.
Маркёр завершения B-лимфопоэза (образования зрелого наивного B-лимфоцита, готового к выходу из костного мозга в периферическую лимфоидную ткань) – одновременная экспрессия (коэкспрессия) на мембране двух типов BCR – IgM и IgD (причём IgD больше, чем IgM).
Иммуногенез. После распознавания антигена и вступления в иммунный ответ B-лимфоцит проходит в фолликулах периферических лимфоидных органов и тканей ещё 2 стадии додифференцировки, называемые иммуногенезом.
• Пролиферация центробластов. В зародышевых центрах фолликуллов B-лимфоциты, называемые на этой стадии центробластами, интенсивно пролиферируют, удерживаясь связями со специальными клетками стромы – ФДК.
– На ФДК экспрессированы необычные рецепторы для иммуноглобулинов (FcR), способные продолжительное время (дни, месяцы, возможно, годы) удерживать комплекс антиген-антитело на мембране клетки.
– В зародышевых центрах происходит возрастание аффинности антител в отношении специфичного антигена по механизму гипермутагенеза, так как на этом этапе дифференцировки выживают те из вновь мутировавших B-лимфоцитов, у которых аффинность BCR к антигенам на поверхности ФДК выше. Этот процесс также называют положительной селекцией.
• Выбор дальнейшего пути. На второй стадии иммуногенеза происходит выбор: B-лимфоцит становится либо B-лимфоцитом памяти (дифференцированный резерв на случай повторной встречи с тем же антигеном), либо плазматической клеткой (через промежуточную стадию плазмабласта) – секретирующую большие количества антител заданной специфичности (рис. 5-14).
B1-лимфоциты
Последующая информация будет касаться В1-лимфоцитов мышей. Совершенно очевидно, что у человека присутствуют клетки с функциональными характеристиками В1-лимфоцитов, но четкое разграничение этой популяции на основании поверхностных маркёров пока не сделано.
• B1-лимфоциты подразделяют на 2 субпопуляции: B1a (CD5+) и B1b (CD5–).
• Предшественники B1a-лимфоцитов ещё в эмбриональном периоде мигрируют из эмбриональных кроветворных тканей (фетальной печени, оментума) в брюшную и плевральную полости, где существуют как самоподдерживающаяся популяция, хотя небольшое восполнение из костного мозга всё же присутствует. В1b-лимфоциты тоже происходят из фетальных предшественников, однако их пул у взрослых может существенно пополняться за счёт костного мозга. Помимо полостей, В1-лимфоциты также присутствуют в небольших количествах в селезёнке и лимфатических узлах.
• Предназначение B1-лимфоцитов – быстрый ответ на проникающие в организм широко распространённые патогены (преимуще-

Рис. 5-14. B-лимфоцит и плазматическая клетка.Активированные B-лимфоциты, т.е. распознавшие антигенную детерминанту и получившие активационный сигнал, пролиферируют и заканчивают дифференцировку. Совокупность окончательно дифференцированных потомков B-лимфоцита составляет клон плазматических клеток, синтезирующих антитела (иммуноглобулины) именно к этой и только к этой антигенной детерминанте. Обратите внимание, что в цитоплазме плазматической клетки представлен сильно развитый белоксинтезирующий аппарат – гранулярная эндоплазматическая сеть. На мембране плазматических клеток уже нет ни иммуноглобулинов, ни MHC-II. В этих клетках прекращается переключение классов иммуноглобулинов и гипермутагенез, а дальнейший синтез антител уже не зависит от контакта с антигеном и взаимодействий с T-лимфоцитами
ственно бактерии). Почти все антитела В1-клеток принадлежат к IgM-изотипу и распознают наиболее распространённые соединения клеточных стенок бактерий. Преобладающая часть нормального IgM сыворотки крови здорового человека синтезируется именно B1-лимфоцитами. • Предполагают, что основная функция B1a-клеток – секреция естественных антител. Ещё до встречи с каким бы то ни было внешним антигеном в крови и биологических жидкостях организма уже присутствуют так называемые естественные (конститутивные) иммуноглобулины. У взрослых большинство из них относится к IgM, но есть также IgA и IgG. Эти антитела полиспецифичны и способны перекрестно связывать множество антигенов, включая аутоантиге-
ны. У мышей секреция естественных антител в основном происходит в селезёнке.
• Естественные антитела (их чаще называют «нормальные иммуноглобулины») выполняют ряд весьма важных для здоровья организма функций: «первая линия обороны» против патогенов; удаление из организма погибших клеток и продуктов катаболизма; презентация антигенов T-лимфоцитам; поддержание гомеостаза аутоиммунной реактивности (участвуют в поддержании толерантности к аутоантигенам, например, гистонам); противовоспалительное действие (нейтрализация суперантигенов, индукция синтеза противовоспалительных цитокинов, аттенуация комплементзависимого повреждения тканей и др.).
• Считается, что B1b-лимфоциты участвуют в продукции антител к Т-независимым антигенам, а также обеспечивают длительную иммунную память к некоторым микроорганизмам.
В-клетки маргинальной зоны
В-клетки маргинальной зоны (MZB) развиваются из костномозговых предшественников и находятся в маргинальных синусах селезёнки. Их основной задачей является ответ на Т-независимые антигены, находящиеся в крови. Поскольку для ответа на такие антигены не требуется сложной кооперации нескольких типов клеток, он развивается в кратчайшие сроки. MZB-клетки отличаются от В1а-лифоцитов по «происхождению», но функционально очень похожи. Обе эти популяции преимущественно экспрессируют антитела класса IgM, специфичные к полисахаридам и фосфолипидам (например, фосфорилхолину), расположенным на поверхности бактерий. Они также способны очень быстро дифференцироваться в плазматические клетки. Еще одной сходной чертой является почти полное отсутствие гипермутагенеза в генах, кодирующих экспрессируемые этими клетками иммуноглобулины.
Тимуснезависимые антигены
Некоторые антигены способны вызывать иммунный ответ с участием В-лимфоцитов, но без помощи T-лимфоцитов. Этот тип иммунного ответа характеризуется рядом особенностей: вырабатываются антитела только IgM-изотипа (обычно переключения изотипов нет, однако у мышей выявляют IgG3, специфичные к таким антигенам). При ответе на Т-независимые антигены иммунная память обычно не развивается, кроме того, не происходит «созревания» аффинности. Однако у подобного
ответа есть и преимущество: он развивается уже в первые двое суток после проникновения антигена и начинает защищать организм на ранних сроках инфекции, пока тимусзависимый ответ ещё не сформировался.
Антигены такого типа называют тимуснезависимыми и подразделяют на два класса.
• Тимуснезависимые антигены 1-го типа (ТН-1) в достаточно высоких концентрациях способны индуцировать поликлональную активацию B-лимфоцитов (зрелых и незрелых) и продукцию поликлональных иммуноглобулинов класса IgM. Эти вещества ещё называют B-клеточными митогенами. Бактериальный ЛПС – классический пример ТН-1-антигена. ЛПС связывается с BCR и в то же время активирует TLR4, запуская одновременно 2 сигнала, которые достаточны для поликлональной активации В-лимфоцитов.
• Тимуснезависимые антигены 2-го типа (ТН-2) представлены достаточно длинными молекулами с повторяющимися структурами (полисахариды бактериальных стенок, фиколл). Эти антигены мультивалентны и могут вызывать перекрёстную сшивку иммуноглобулиновых рецепторов. ТН-2, в отличие от ТН-1, способны активировать только зрелые B-лимфоциты – преимущественно B1. В незрелых B-клетках повторяющиеся антигенные эпитопы индуцируют анергию или апоптоз.
Взаимодействие Т-независимых антигенов с В-лимфоцитами проиллюстрировано на рис. 5-15.

Рис. 5-15. Разновидности Т-независимых антигенов

