VMP 20.12.2018
Иммунология: структура и функции иммунной системы: учебное пособие / Р.М. Хаитов. – 2013. – 280 с.



Глава 6. Т-ЛИМФОЦИТЫ
Основная задача T-лимфоцитов – распознавание чужеродных или изменённых собственных антигенов в составе комплекса с молекулами MHC. Если на поверхности своих клеток будут представлены чужеродные или изменённые свои молекулы, T-лимфоцит запускает их уничтожение.
• В отличие от B-лимфоцитов, T-лимфоциты не продуцируют растворимых форм антигенраспознающих молекул. Более того, большинство T-лимфоцитов не способны распознавать и связывать растворимые антигены.
• Для того чтобы T-лимфоцит «обратил на антиген своё внимание», другие клетки должны каким-то образом «пропустить» антиген через себя и выставить его на своей мембране в комплексе с MHC-I или MHC-II. Это и есть феномен презентации антигена T-лимфоциту. Распознавание такого комплекса T-лимфоцитом – двойное распознавание, или MHC-рестрикция T-лимфоцитов.
АНТИГЕНРАСПОЗНАЮЩИЙ РЕЦЕПТОР T-ЛИМФОЦИТОВ
Антигенраспознающие рецепторы T-клеток – TCR состоят из цепей, принадлежащих к суперсемейству иммуноглобулинов (см. рис. 5-1). Выступающий над поверхностью клетки антигенраспознающий участок TCR – гетеродимер, т.е. состоит из двух разных полипептидных цепей. Известны два варианта TCR, обозначаемые как αβTCR и γδTCR. Эти варианты различаются составом полипептидных цепей антигенраспознающего участка. Каждый T-лимфоцит экспрессирует только 1 вариант рецептора. αβT-клетки были открыты раньше и изучены подробнее, чем γδT-лимфоциты. В связи с этим строение антигенраспознающего рецептора T-лимфоцитов удобнее описывать на примере αβTCR. Трансмембранно расположенный комплекс TCR состоит из 8 полипептидных
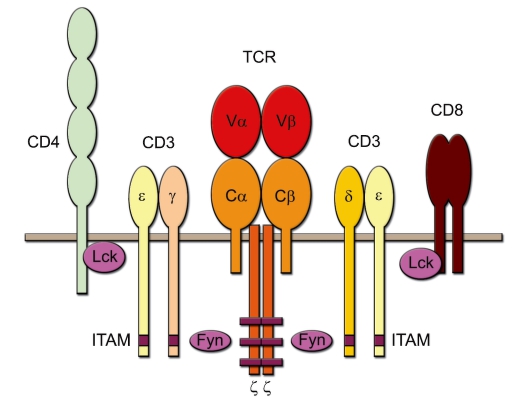
Рис. 6-1. Схема Т-клеточного рецептора и связанных с ним молекул
цепей (гетеродимера α- и β-цепей собственно TCR, двух вспомогательных цепей ζ, а также по одному гетеродимеру ε/δ- и ε/γ-цепей молекулы СD3) (рис. 6-1).
• Трансмембранные цепи α и β TCR. Это 2 примерно одинаковые по размеру полипептидные цепи – α (молекулярная масса 40-60 кДа, кислый гликопротеин) и β (молекулярная масса 40-50 кДа, нейтральный или основный гликопротеин). Каждая из этих цепей содержит по 2 гликозилированных домена во внеклеточной части рецептора, гидрофобную (положительно заряженную за счёт остатков лизина и аргинина) трансмембранную часть и короткий (из 5-12 остатков аминокислот) цитоплазматический участок. Внеклеточные части обеих цепей соединены одной дисульфидной связью.
– V-область. Наружные внеклеточные (дистальные) домены обеих цепей имеют вариабельный аминокислотный состав. Они гомологичны V-области молекул иммуноглобулинов и составляют V-область TCR. Именно V-области α- и β-цепей вступают в связь с комплексом MHC-пептид.
– C-область. Проксимальные домены обеих цепей гомологичны константным областям иммуноглобулинов; это C-области TCR.
– Короткий цитоплазматический участок (как α-, так и β-цепи) не может самостоятельно обеспечить проведение сигнала внутрь клетки. Для этого служат 6 дополнительных полипептидных цепей: γ, δ, 2ε и 2ζ.
• Комплекс CD3. Цепи γ, δ, ε между собой образуют гетеродимеры γε и δε (вместе их называют комплекс CD3). Этот комплекс необходим для экспрессии α- и β-цепей, их стабилизации и проведения сигнала внутрь клетки. Этот комплекс состоит из внеклеточной, трансмембранной (отрицательно заряженной и потому электростатически связанной с трансмембранными участками α- и β-цепей) и цитоплазматической частей. Важно не путать цепи CD3-комплекса с γδ-цепями димера TCR.
• ζ-Цепи соединены между собой дисульфидным мостиком. Большая часть этих цепей расположена в цитоплазме. ζ-Цепи осуществляют проведение сигнала внутрь клетки.
• ITAM-последовательности. Цитоплазматические участки полипептидных цепей γ, δ, ε и ζ содержат 10 последовательностей ITAM (1 последовательность в каждой γ-, ε- и δ-цепях и 3 – в каждой ζ-цепи), взаимодействующих с Fyn – тирозинкиназой цитозоля, активация которой инициирует начало биохимических реакций по проведению сигнала (см. рис. 6-1).
В связывании антигена участвуют ионные, водородные, ван-дерваальсовы и гидрофобные силы; конформация рецептора при этом существенно изменяется. Теоретически каждый TCR способен связывать порядка 105 разных антигенов, причём не только родственных по строению (перекрёстно реагирующих), но и не гомологичных по структуре. Однако в реальности полиспецифичность TCR ограничивается распознаванием всего лишь нескольких структурно схожих антигенных пептидов. Структурной основой этого феномена является особенность одновременного распознавания TCR комплекса «МНС-пептид».
Корецепторные молекулы CD4 и CD8
Помимо самого TCR каждый зрелый T-лимфоцит экспрессирует одну из так называемых корецепторных молекул – CD4 или CD8, которые также взаимодействуют с молекулами MHC на АПК или клеткахмишенях. Каждая из них имеет цитоплазматический участок, связанный
с тирозинкиназой Lck, и, вероятно, вносит свой вклад в проведение сигнала внутрь клетки при распознавании антигена.
• CD4 связывается с инвариантной частью (β2-доменом) молекулы MHC-II (принадлежит к суперсемейству иммуноглобулинов, см. рис. 5-1, б). CD4 имеет молекулярную массу 55 кДа и 4 домена во внеклеточной части. При активации T-лимфоцита одну молекулу TCR «обслуживают» 2 молекулы CD4: вероятно, происходит димеризация молекул CD4.
• CD8 связывается с инвариантной частью (αЗ-доменом) молекулы MHC-I (принадлежит к суперсемейству иммуноглобулинов, см. рис. 5-1, а). CD8 – гетеродимер цепей α и β, соединённых дисульфидной связью. В некоторых случаях обнаруживают гомодимер из двух α-цепей, который также может взаимодействовать с MHC-I. Во внеклеточной части каждая из цепей имеет по одному иммуноглобулиноподобному домену.
Гены T-клеточного рецептора
Гены α-, β-, γ- и δ-цепей (рис. 6-2, также см. рис. 5-4) гомологичны генам иммуноглобулинов и претерпевают при дифференцировке T-лимфоцитов рекомбинацию ДНК, что теоретически обеспечивает генерацию порядка 1016-1018 вариантов антигенсвязывающих рецепторов (реально это разнообразие ограничено числом лимфоцитов в организме до 109).
• Гены α-цепи имеют ~54 V-сегмента, 61 J- и 1 C-сегмент.
• Гены β-цепи содержат ~65 V-сегментов, 2 D-сегмента, 13 J-сегментов и 2 C-сегмента.
• Гены δ-цепи. Между V- и J-сегментами α-цепи расположены гены D-(3), J-(4) и C-(1) сегментов δ-цепи γδTCR. V-сегменты δ-цепи «вкраплены» среди V-сегментов α-цепи.
• Гены γ-цепи γδTCR имеют 2 C-сегмента, 3 J-сегмента перед первым C-сегментом и 2 J-сегмента перед вторым C-сегментом, 15 V-сегментов.
Перестройка генов
• Рекомбинация ДНК происходит при объединении V-, D- и J-сегментов и катализируется тем же комплексом рекомбиназ, что и при дифференцировке B-лимфоцитов.
• После перестройки VJ в генах α-цепи и VDJ в генах β-цепи, а также после присоединения некодируемых N- и P-нуклеотидов с ДНК
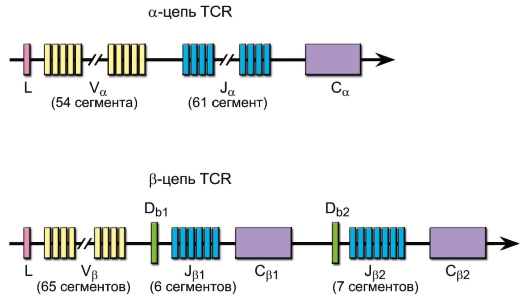
Рис. 6-2. Гены α- и β-цепей антигенраспознающего рецептора T-лимфоцитов человека
транскрибируется РНК. Объединение с C-сегментом и удаление лишних (неиспользуемых) J-сегментов происходит при сплайсинге первичного транскрипта.
• Гены α-цепи могут перестраиваться неоднократно при уже правильно перестроенных и экспрессированных генах β-цепи. Именно поэтому есть некоторая вероятность того, что одна клетка может нести более одного варианта TCR.
• Соматическому гипермутагенезу гены TCR не подвергаются.
ПРОВЕДЕНИЕ СИГНАЛА С АНТИГЕНРАСПОЗНАЮЩИХ РЕЦЕПТОРОВ ЛИМФОЦИТОВ
TCR и BCR имеют ряд общих закономерностей регистрации и проведения в клетку активационных сигналов (см. рис. 5-11).
• Кластеризация рецепторов. Для активации лимфоцита необходима кластеризация антигенраспознающих рецепторов и корецепторов, т.е. «сшивка» нескольких рецепторов одним антигеном.
• Тирозинкиназы. В проведении сигнала играют значительную роль процессы фосфорилирования/дефосфорилирования белков по остатку тирозина под действием тирозинкиназ и тирозинфосфатаз,
ведущие к активации или инактивации этих белков. Эти процессы легко обратимы и «удобны» для быстрых и гибких реакций клетки на внешние сигналы.
• Киназы Src. Богатые тирозином ITAM-последовательности цитоплазматических участков иммунорецепторов подвергаются фосфорилированию под действием нерецепторных (цитоплазматических) тирозинкиназ семейства Src (Fyn, Blk, Lyn в B-лимфоцитах, Lck и Fyn – в T-лимфоцитах).
• Киназы ZAP-70 (в T-лимфоцитах) или Syk (в B-лимфоцитах), связываясь с фосфорилированными ITAM-последовательностями, активируются и начинают фосфорилировать адапторные белки: LAT (Linker for Activation of T cells) (киназой ZAP-70), SLP-76 (киназой ZAP-70) или SLP-65 (киназой Syk).
• Адапторные белки рекрутируют фосфоинозитид-3-киназу (PI3K). Эта киназа в свою очередь активирует серин/треониновую протеинкиназу Akt, вызывая усиление белкового биосинтеза, что способствует ускоренному росту клеток.
• Фосфолипаза Cγ (см. рис. 4-8). Киназы семейства Tec (Btk – в B-лимфоцитах, Itk – в T-лимфоцитах) связывают адапторные белки и активируют фосфолипазу Cγ (PLCγ).
– PLCγ расщепляет фосфатидилинозитдифосфат (PIP2) клеточной мембраны на инозит-1,4,5-трифосфат (IP3) и диацилглицерин
(DAG).
– DAG остаётся в мембране и активирует протеинкиназу С (PKC) – серин/треониновую киназу, которая активирует эволюционно «древний» фактор транскрипции NFκB.
– IP3 связывается со своим рецептором в эндоплазматическом ретикулуме и высвобождает ионы кальция из депо в цитозоль.
– Свободный кальций активирует кальцийсвязывающие белки – кальмодулин, регулирующий активность ряда других белков, и кальциневрин, дефосфорилирующий и тем самым активирующий ядерный фактор активированных T-лимфоцитов NFAT (Nuclear Factor of Activated T cells).
• Ras и другие малые G-белки в неактивном состоянии связаны с ГДФ, но адапторные белки заменяют последний на ГТФ, чем переводят Ras в активное состояние.
– Ras обладает собственной ГТФазной активностью и быстро отщепляет третий фосфат, чем возвращает себя в неактивное состояние (самоинактивируется).
– В состоянии кратковременной активации Ras успевает активировать очередной каскад киназ, называемых MAPK (MitogenActivated Protein Kinase), которые в итоге активируют фактор транскрипции AP-1 в ядре клетки. На рис. 6-3 схематично представлены основные пути передачи сигналов с TCR. Активационный сигнал включается при связывании TCR с лигандом (комплексом молекула МНС-пептид) при участии корецептора (CD4 или CD8) и костимулирующей молекулы CD28. Это приводит к активации киназ Fyn и Lck. Красным цветом отмечены участки ITAM в цитоплазматических частях полипептидных цепей CD3. Отражена роль Src-киназ, связанных с рецептором, в фосфорилировании белков: как рецепторных, так и сигнальных. Обращает на себя внимание чрезвычайно широкий спектр эффектов киназы Lck, связанной с корецепторами; роль киназы Fyn установлена с меньшей определённостью (отражено в прерывистом характере линий).
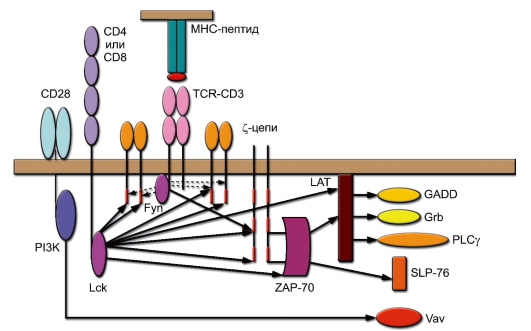
Рис. 6-3. Источники и направление пусковых активационных сигналов при стимуляции Т-лимфоцитов. Обозначения: ZAP-70 (ζ-associated proteinkinase, мол. масса 70 кДа) – протеинкиназа р70, связанная с ζ-цепью; PLCγ (Phospholipase Сγ) – фосфолипаза С, изоформа γ; PI3K (Phosphatidyl Inositol 3-kinase) – фосфатидилинозитол 3-киназа; Lck, Fyn -тирозинкиназы; LAT, Grb, SLP, GADD, Vav – адапторные белки
Ключевую роль в посредничестве между рецепторными киназами и адапторными молекулами и ферментами играет тирозинкиназа ZAP-70. Она активирует (через фосфорилирование) адапторные молекулы SLP-76 и LAT, а последняя передаёт активационный сигнал другим адапторным белкам GADD, GRB и активирует у-изоформу фосфолипазы С (PLCy). До этого этапа в передачу сигнала вовлекаются исключительно факторы, связанные с клеточной мембраной. Важный вклад во включение сигнальных путей вносит костимулирующая молекула CD28, реализующая своё действие через связанную с ней липидную киназу PI3K (Phosphatidyl Inositol 3-kinase). Основной мишенью киназы PI3K служит фактор Vav, связанный с цитоскелетом.
В результате формирования сигнала и передачи его от рецептора Т-клетки к ядру образуются 3 транскрипционных фактора – NFAT, AP-1 и NF-kB, индуцирующие экспрессию генов, контролирующих процесс активации Т-лимфоцитов (рис. 6-4). К образованию NFAT приводит сигнальный путь, не зависящий от костимуляции, который включается благодаря активации фосфолипазы С и реализуется с участием ионов
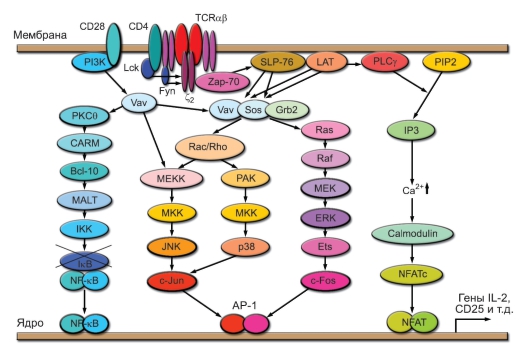
Рис. 6-4. Схема сигнальных путей при активации Т-клеток. NFAT (Nuclear factor of activated T cells), AP-1 (Activation protein-1), NF-κB (Nuclear factor of к-gene of B cells) – факторы транскрипции
Са2+. Этот путь вызывает активацию кальциневрина, который, обладая активностью фосфатазы, дефосфорилирует цитозольный фактор NFAT-Р. Благодаря этому NFAT-Р приобретает способность мигрировать в ядро и связываться с промоторами активационных генов. Фактор АР-1 формируется как гетеродимер из белков с-Fos и с-Jun, образование которых индуцируется благодаря активации соответствующих генов под влиянием факторов, образующихся в результате реализации трёх компонентов МАР-каскада. Эти пути включаются при участии коротких ГТФ-связывающих белков Ras и Rac. Значительный вклад в реализацию МАР-каскада вносят сигналы, зависящие от костимуляции через молекулу CD28. Третий транскрипционный фактор, NF-kB, известен как основной транскрипционный фактор клеток врождённого иммунитета. Он активируется в результате расщепления блокирующей субъединицы IkB киназой IKK, которая в Т-клетках активируется в ходе передачи сигнала, зависимого от изоформы ϴ протеинкиназы С (PKC9). Основной вклад во включение этого сигнального пути вносят костимулирующие сигналы от CD28. Сформировавшиеся транскрипционные факторы, связавшись с промоторными участками генов, индуцируют их экспрессию. Для начальных этапов реакции Т-клеток на стимуляцию особенно важна экспрессия генов IL2 и IL2R, что обусловливает выработку ростового фактора Т-клеток ИЛ-2 и экспрессию его высокоаффинного рецептора на Т-лимфоцитах. В результате ИЛ-2 выступает как аутокринный ростовой фактор, обусловливающий пролиферативную экспансию Т-клеток клонов, вовлечённых в реакцию на антиген.
ДИФФЕРЕНЦИРОВКА T-ЛИМФОЦИТОВ
В основе выделения этапов развития Т-лимфоцитов лежит состояние рецепторных V-генов и экспрессии TCR, а также корецепторов и других мембранных молекул. Схема дифференцировки Т-лимфоцитов (рис. 6-5) аналогична приведённой выше схеме развития В-лимфоцитов (см. рис. 5-13). Приведены ключевые характеристики фенотипа и ростовых факторов развивающихся Т-клеток. Принятые обозначения стадий развития Т-клеток определяются экспрессией корецепторов: DN (от Double-Negative, CD4CD8) – двойные отрицательные, DP (от Double-Positive, CD4+CD8+) – двойные положительные, SP (от Single-Positive, CD4+CD8– и CD4CD8+) – одинарно положительные. Деление DNтимоцитов на стадии DN1, DN2, DN3 и DN4 основывается на характере
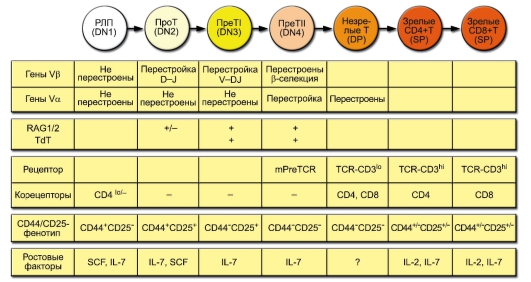
Рис. 6-5. Развитие Т-лимфоцитов
экспрессии молекул CD44 и CD25. Другие условные обозначения: SCF (от Stem Cell Factor) – фактор стволовых клеток, lo (low; метка индекса) – низкий уровень экспрессии. Стадии реаранжировки: D-J – предварительный этап, соединение сегментов D и J (только в генах β- и δ-цепей TCR, см. рис. 6-2), V-DJ – завершающий этап, соединение зародышевого V-гена с объединённым сегментом DJ.
• Тимоциты дифференцируются из общей клетки-предшественника, которая ещё вне тимуса экспрессирует такие мембранные маркёры, как CD7, CD2, CD34 и цитоплазматическую форму CD3.
• Коммитированные к дифференцировке в T-лимфоциты клеткипредшественники мигрируют из костного мозга в субкапсулярную зону коры тимуса, где примерно в течение одной недели медленно пролиферируют. На тимоцитах появляются новые мембранные молекулы CD44 и CD25.
• Затем клетки перемещаются вглубь коры тимуса, молекулы CD44 и CD25 исчезают с их мембраны. В этой стадии начинается перестройка генов β-, γ- и δ-цепей TCR. Если гены γ- и δ-цепей успевают продуктивно, т.е. без сдвига рамки считывания, перестроиться раньше, чем гены β-цепи, то лимфоцит дифференцируется далее как γδT. В противном случае происходит экспрессия β-цепи на мембране в комплексе с pTα (инвариантной суррогатной цепью, заменяющей на этом этапе настоящую α-цепь) и CD3. Это служит
сигналом к прекращению перестройки генов γ- и δ-цепей. Клетки начинают пролиферировать и экспрессировать одновременно CD4 и CD8 – дважды позитивные тимоциты. При этом накапливается масса клеток с уже готовой β-цепью, но с ещё не перестроенными генами α-цепи, что вносит свой вклад в разнообразие αβ-гетеродимеров.
• На следующем этапе клетки перестают делиться и начинают перестраивать Vα-гены, причём несколько раз в течение 3-4 сут. Перестройка генов α-цепи приводит к необратимой делеции δ-локуса, расположенного между сегментами генов α-цепи.
• Происходят экспрессия TCR с каждым новым вариантом α-цепи и отбор (селекция) тимоцитов по силе связывания с комплексом MHC-пептид на мембранах эпителиальных клеток тимуса.
– Позитивная селекция: погибают тимоциты, не связавшие ни одного из доступных комплексов MHC-пептид. В результате позитивной селекции в тимусе погибает около 90% тимоцитов.
– Негативная селекция уничтожает клоны тимоцитов, связывающих комплексы MHC-пептид со слишком высокой аффинностью. Негативная селекция элиминирует от 10 до 70% клеток, прошедших позитивную селекцию.
– Тимоциты, связавшие какой-либо из комплексов MHC-пептид с правильной, т.е. средней по силе, аффинностью, получают сигнал к выживанию и продолжают дифференцировку.
• На короткое время с мембраны тимоцитов исчезают обе корецепторные молекулы, а затем экспрессируется одна из них: тимоциты, распознавшие пептид в комплексе с MHC-I, экспрессируют корецептор CD8, а с MHC-II – корецептор CD4. Соответственно на периферию выходят (в соотношении около 2:1) T-лимфоциты двух типов: CD8+ и CD4+, функции которых в предстоящих иммунных ответах различны.
– CD8+ T-клетки играют роль цитотоксических T-лимфоцитов (ЦТЛ) – они распознают и непосредственно убивают клетки, модифицированные вирусом, опухолевые и другие «изменённые» клетки (рис. 6-6).
– CD4+ T-клетки. Функциональная специализация CD4+ T-лимфоцитов более разнообразна. Значительная часть CD4+ T-лимфоцитов в процессе развития иммунного ответа становится T-хелперами (помощниками), взаимодействующими с В-лимфоцитами, Т-лимфоцитами и другими клетками при
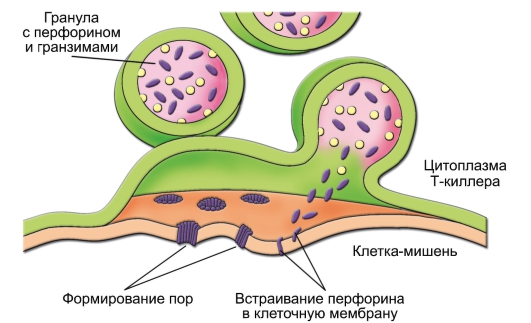
Рис. 6-6. Механизм воздействия цитотоксического T-лимфоцита на клеткумишень. В Т-киллере в ответ на увеличение концентрации Са2+ гранулы с перфорином (фиолетовые овалы) и гранзимами (жёлтые кружочки) сливаются с клеточной мембраной. Освободившийся перфорин встраивается в мембрану клетки-мишени с последующим образованием пор, проницаемых для гранзимов, воды и ионов. В результате клетка-мишень лизируется
прямом контакте или через растворимые факторы (цитокины). В определённых случаях из них могут развиться CD4+ ЦТЛ: в частности, такие T-лимфоциты обнаружены в значительных количествах в коже больных с синдромом Лайелла.
Субпопуляции T-хелперов
С конца 80-х годов XX века было принято выделять 2 субпопуляции T-хелперов (в зависимости от того, какой набор цитокинов они продуцируют) – Th1 и Th2. В последние годы спектр субпопуляций CD4+ Т-клеток продолжает расширяться. Обнаружены такие субпопуляции, как: Th17, T-регуляторы, Tr1, Th3, Tfh и др.
Основные субпопуляции CD4+ Т-клеток:
• Th0 – CD4+ Т-лимфоциты на ранних стадиях развития иммунного ответа, они продуцируют только ИЛ-2 (митоген для всех лимфоцитов).
• Th1 – дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на продукции ИФНγ, ФНОβ и ИЛ-2. Эта субпопуляция осуществляет регуляцию многих реакций клеточного иммунитета, включая гиперчувствительность замедленного типа (ГЗТ) и активацию ЦТЛ. Кроме того, Th1 стимулируют продукцию В-лимфоцитами опсонизирующих антител класса IgG, запускающих каскад активации комплемента. Развитие избыточного воспаления с последующим повреждением тканей напрямую связано с активностью Th1-субпопуляции.
• Th2 – дифференцированная субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на выработке ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10 и ИЛ-13. Эта субпопуляция участвует в активации В-лимфоцитов и способствует секреции ими больших количеств антител разных классов, особенно IgE. Кроме того, Th2-субпопуляция участвует в активации эозинофилов и развитии аллергических реакций.
• Th17 – субпопуляция CD4+ Т-лимфоцитов, специализирующаяся на образовании ИЛ-17. Эти клетки осуществляют противогрибковую и антимикробную защиту эпителиальных и слизистых барьеров, а также играют ключевую роль в патологии аутоиммунных заболеваний.
• Т-регуляторы – CD4+ Т-лимфоциты, подавляющие активность других клеток иммунной системы посредством секреции иммуносупрессорных цитокинов – ИЛ-10 (ингибитора активности макрофагов и Th1-клеток) и ТФРβ – ингибитора пролиферации лимфоцитов. Ингибиторный эффект может также достигаться при непосредственном межклеточном взаимодействии, поскольку на мембране некоторых Т-регуляторов экспрессированы индукторы апоптоза активированных и «отработавших» лимфоцитов – FasL (Fas-лиганд). Существует несколько популяций CD4+ регуляторных Т-лимфоцитов: естественные (Treg), созревающие в тимусе (CD4+CD25+, экспрессируют фактор транскрипции Foxp3), и индуцированные – локализованные преимущественно в слизистых оболочках пищеварительного тракта и переключившиеся на образование ТФРβ (Th3) или ИЛ-10 (Tr1). Нормальное функционирование Т-регуляторов необходимо для поддержания гомеостаза иммунной системы и предотвращения развития аутоиммунных заболеваний.
• Дополнительные хелперные популяции. В последнее время появляется описание всё новых популяций CD4+ Т-лимфоцитов, клас-
сифицированных по типу преимущественно продуцируемого ими цитокина. Так, как оказалось, одной из важнейших популяций являются Tfh (от англ. follicular helper – фолликулярный хелпер). Эта популяция CD4+ Т-лимфоцитов преимущественно расположена в лимфоидных фолликулах и осуществляет хелперную функцию для В-лимфоцитов посредством продукции ИЛ-21, вызывая их созревание и терминальную дифференцировку в плазматические клетки. Кроме ИЛ-21 Tfh могут также продуцировать ИЛ-6 и ИЛ-10, необходимые для дифференцировки В-лимфоцитов. Нарушение функций этой популяции приводит к развитию аутоиммунных заболеваний или иммунодефицитов. Другой «новоявленной» популяцией являются Th9 – продуценты ИЛ-9. По-видимому, это Th2, переключившиеся на секрецию ИЛ-9, способного вызывать пролиферацию Т-хелперных клеток при отсутствии антигенной стимуляции, а также усиливать секрецию В-лимфоцитами IgM, IgG и IgE.
Основные субпопуляции Т-хелперов представлены на рис. 6-7. На рисунке суммированы современные представления об адаптивных субпопуляциях CD4+ Т-клеток, т.е. субпопуляций, формирующих-
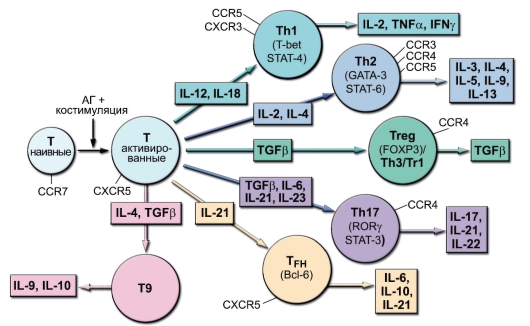
Рис. 6-7. Адаптивные субпопуляции CD4+ Т-клеток (цитокины, дифференцировочные факторы, хемокиновые рецепторы)
ся при иммунном ответе, а не в ходе естественного развития клеток. Для всех разновидностей Т-хелперов указаны цитокины-индукторы (на стрелках, ведущих к кружкам, символизирующим клетки), транскрипционные факторы (внутри кружков), хемокиновые рецепторы, направляющие миграцию (около линий, отходящих от «поверхности клетки»), и продуцируемые цитокины (в прямоугольниках, на которые направлены стрелки, отходящие от кружков).
Расширение семейства адаптивных субпопуляций CD4+ Т-клеток потребовало решения вопроса о природе клеток, с которыми взаимодействуют эти субпопуляции (кому они оказывают «помощь» в соответствии со своей функцией хелперов). Эти представления отражены на рис. 6-8. Здесь же представлен уточнённый взгляд на функции этих субпопуляций (участие в защите от определённых групп патогенов), а также о патологических последствиях несбалансированного усиления активности этих клеток.
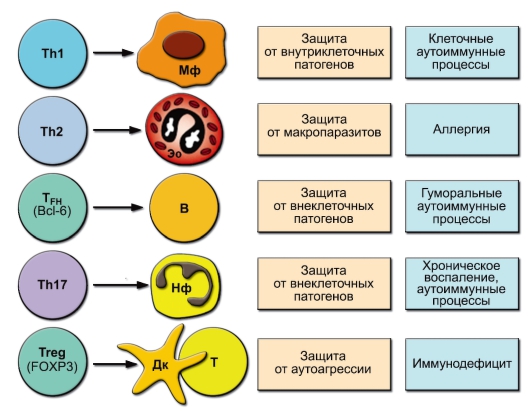
Рис. 6-8. Адаптивные субпопуляции Т-клеток (клетки-партнёры, физиологические и патологические эффекты)
γδT-лимфоциты
Подавляющее большинство (99%) T-лимфоцитов, проходящих лимфопоэз в тимусе, составляют αβT-клетки; менее 1% – γδT-клетки. Последние в большинстве дифференцируются вне тимуса, в первую очередь в слизистых оболочках пищеварительного тракта. В коже, лёгких, пищеварительном и репродуктивном трактах они являются доминирующей субпопуляцией внутриэпителиальных лимфоцитов. Среди всех T-лимфоцитов организма γδT-клетки составляют от 10 до 50%. В эмбриогенезе γδT-клетки появляются раньше αβT-клеток.
• γδT-клетки не экспрессируют CD4. Молекула CD8 экспрессирована на части γδT-клеток, но не в виде ap-гетеродимера, как на CD8+ apT-клетках, а в виде гомодимера из двух a-цепей.
• Антигенраспознающие свойства: γδTCR в большей степени напоминают иммуноглобулины, чем αβTCR, т.е. способны связывать нативные антигены независимо от классических молекул MHC – для γδT-клеток не обязателен или вовсе не нужен предварительный процессинг антигена АПК.
• Разнообразие γδTCR меньше, чем αβTCR или иммуноглобулинов, хотя в целом γδT-клетки способны распознавать широкий спектр антигенов (в основном это фосфолипидные антигены микобактерий, углеводы, белки теплового шока).
• Функции γδT-клеток ещё до конца не изучены, хотя становится преобладающим мнение, что они служат одним из связующих компонентов между врождённым и приобретённым иммунитетом. γδT-клетки – один из первых барьеров на пути патогенов. Кроме того, эти клетки, секретируя цитокины, играют важную иммунорегуляторную роль и способны дифференцироваться в ЦТЛ.
NKT-лимфоциты
Естественные киллерные Т-клетки (NKT-клетки) представляют особую субпопуляцию лимфоцитов, занимающую промежуточное положение между клетками врождённого и адаптивного иммунитета. Эти клетки имеют черты как NK-, так и Т-лимфоцитов. NKT-клетки экспрессируют αβTCR и характерный для NK-клеток рецептор NK1.1, принадлежащий к суперсемье лектиновых гликопротеинов С-типа. Однако TCR-рецептор NKT-клеток имеет существенные отличия от TCR-рецептора обычных клеток. У мышей большинство NKTклеток экспрессирует инвариантный V-домен a-цепи, состоящий из
сегментов Vα14-Jα18, иногда обозначаемый как Jα281. У человека V-домен α-цепи состоит из сегментов Vα24-JαQ. У мышей α-цепь инвариантного TCR преимущественно комплексируется с Vβ8.2, у человека – с Vβ11. Из-за особенностей строения цепей TCR NKTклеток называют инвариантным – iTCR. Развитие NKT-клеток зависит от молекулы CD1d, которая имеет сходство с молекулами МНС-I. В отличие от классических молекул МНС-I, презентирующих Т-клеткам пептиды, CD1d презентирует Т-клеткам только гликолипиды. Хотя считается, что печень является местом развития NKT-клеток, имеются строгие доказательства роли тимуса в их развитии. NKT-клетки играют важную роль в регуляции иммунитета. У мышей и людей с различными аутоиммунными процессами функциональная активность NKT-клеток сильно нарушена. Полной картины значимости таких нарушений в патогенезе аутоиммунных процессов нет. При некоторых аутоиммунных процессах NKT-клетки могут играть супрессорную роль.
Помимо контроля аутоиммунных и аллергических реакций, NKTклетки участвуют в иммунном надзоре, вызывая при повышении функциональной активности отторжение опухолей. Велика их роль в противомикробной защите, особенно на ранних этапах развития инфекционного процесса. NKT-клетки вовлекаются в различные воспалительные инфекционные процессы, особенно при вирусных поражениях печени. В целом NKT-клетки – многофункциональная популяция лимфоцитов, несущая ещё много научных загадок.
На рис. 6-9 обобщены данные о дифференцировке Т-лимфоцитов на функциональные субпопуляции. Представлены несколько уровней бифуркации: γδТ/αβТ, далее для αβТ-клеток – NKT/ остальные Т-лимфоциты, для последних – CD4+/CD8+, для CD4+ Т-клеток – Th/Treg, для CD8+ Т-лимфоцитов – CD8αβ/CD8αα. Показаны также дифференцировочные транскрипционные факторы, ответственные за все линии развития.
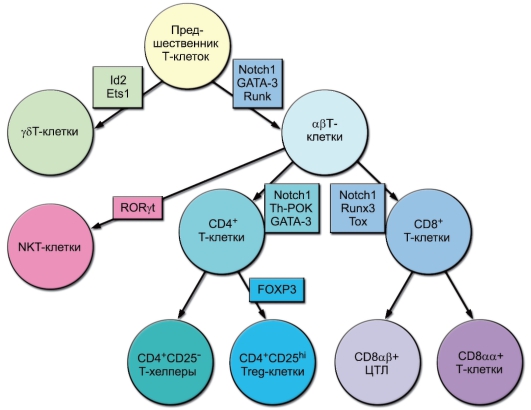
Рис. 6-9. Естественные субпопуляции Т-лимфоцитов и их дифференцировочные факторы
Глава 7. АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ
Лейкоцитарные антигены человека (HLA – Human Leukocyte Antigens) – гликопротеины, кодируемые генами главного комплекса гистосовместимости – MHC (Major Histocompatibility Complex). Они определяют биологическую индивидуальность каждого человека. В иммунной системе эти гликопротеины выполняют важнейшую функцию: они участвуют в презентации АПК пептидных антигенов Т-лимфоцитам.
ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ
HLA-молекулы, кодируемые генами MHC, подразделяют на гликопротеины MHC класса I (HLA-A, HLA-B и HLA-C), представленные на поверхности всех соматических клеток за исключением клеток ворсинчатого трофобласта и эритроцитов, и MHC класса II (HLA-DP, HLA-DQ и HLA-DR), экспрессированные преимущественно на мембране АПК (ДК, активированных макрофагов и В-лимфоцитов), а также на некоторых T-хелперах.
Соматические клетки в нормальных условиях молекулы MHC-II не экспрессируют. T-лимфоциты с помощью антигенраспознающих рецепторов способны распознавать антигены только в комплексе с молекулами MHC-I или MHC-II на поверхности клеток своего организма – феномен двойного распознавания. Таким образом, природная функция белков MHC – презентация пептидных антигенов T-лимфоцитам.
Первоначально главный комплекс гистосовместимости (MHC) был открыт в опытах по пересадке органов как некий значительный по размеру комплекс генов, от которых больше, чем от других генов, зависит скорость отторжения трансплантата.
Законы трансплантации, описанные в 1912 г. Георгом Шёне в книге «Гетеропластическая и гомопластическая трансплантация»:
• аллогенные и ксеногенные трансплантаты всегда отторгаются;
• аутологичные (донор и реципиент – один и тот же организм) и сингенные (антигены MHC донора и реципиента одинаковы) трансплантаты приживаются;
• гибриды 1-го поколения – F1 (P1×P2) – не отторгают трансплантаты обеих родительских линий (P1, P2), однако каждая из родительских линий отторгает трансплантат от гибрида (это свидетельствует о кодоминантности в гибридах экспрессии генов, кодирующих продукты, служащие мишенью при отторжении). Кодоминантность означает, что экспрессируются аллели на двух гомологичных хромосомах, т.е. от каждого из родителей:
AA × BB → AB,
где А и В – аллели, перешедшие к гибриду F1 от родителей (Р1 и Р2 соответственно).
• При обратном скрещивании (F1 × P1 или F1 × P2) 50% потомства быстро отторгают трансплантат от второй родительской линии (при трансплантации кожного лоскута быстрое отторжение наступает на 8-е сутки). Из этого по законам менделевской генетики следует, что быстрое отторжение контролирует один локус. Его-то и назвали главным комплексом гистосовместимости. А генетическая формула выглядит так:
AB × AA → AA, AA, AB, AB. Гены главного комплекса гистосовместимости
Комплекс MHC весьма значителен по размеру. Он включает около 2000 аллельных вариантов генов. Расположение в геноме локусов комплекса MHC человека схематично изображено на рис. 7-1.
• MHC-I. Гены групп HLA-A, HLA-B, HLA-C и другие кодируют молекулы MHC класса I.
• MHC-II. Гены групп HLA-DP, HLA-DQ и HLA-DR кодируют молекулы MHC класса II.
• MHC-III. Термин «MHC-III» обозначает область между MHC-I и MHC-II, где картированы гены, кодирующие некоторые компоненты системы комплемента (C4a и C4b, C2, фактор В), цитокины (ФНОα и лимфотоксин), 21-гидроксилазу (фермент, участвующий в биосинтезе стероидных гормонов) и др.
• Неклассические гены не принадлежат ни к одному из классов MHC. Описано 6 таких генов в области расположения генов MHC-I (Е, F, G, Н, J, X) и 6 – в области MHC-II (DM, DO, CLIP, TAP, LMP,
LNA).
Трансмембранные молекулы главного комплекса гистосовместимости
• Молекула MHC-I (см. рис. 5-1, а) состоит из двух полипептидных цепей – α-цепи и β2-микроглобулина.
– α-Цепь состоит примерно из 325 аминокислотных остатков, имеет молекулярную массу около 45 кДа и содержит 3 внеклеточных домена (α1, α2, α3), трансмембранный участок и цитоплазматический участок из 55 аминокислотных остатков. Домены α1 и α2 формируют углубление в виде желоба или «корзины» размером 0,25×0,1×0,11 нм для связывания антигенных пептидов длиной 9-11 аминокислот, презентируемых для распознавания T-лимфоцитам.
– С внеклеточными α-доменами нековалентно ассоциирована лёгкая полипептидная цепь с молекулярной массой 11,5 кДа, называемая β2-микроглобулином, которая кодируется геном, расположенным вне комплекса MHC, на хромосоме 15.
• Молекулы MHC-II (см. рис. 5-1, б) – гетеродимеры из двух трансмембранных гликопротеинов: α-цепи (молекулярная масса 34 кДа) и β-цепи (молекулярная масса 29 кДа). Внеклеточная часть каждой
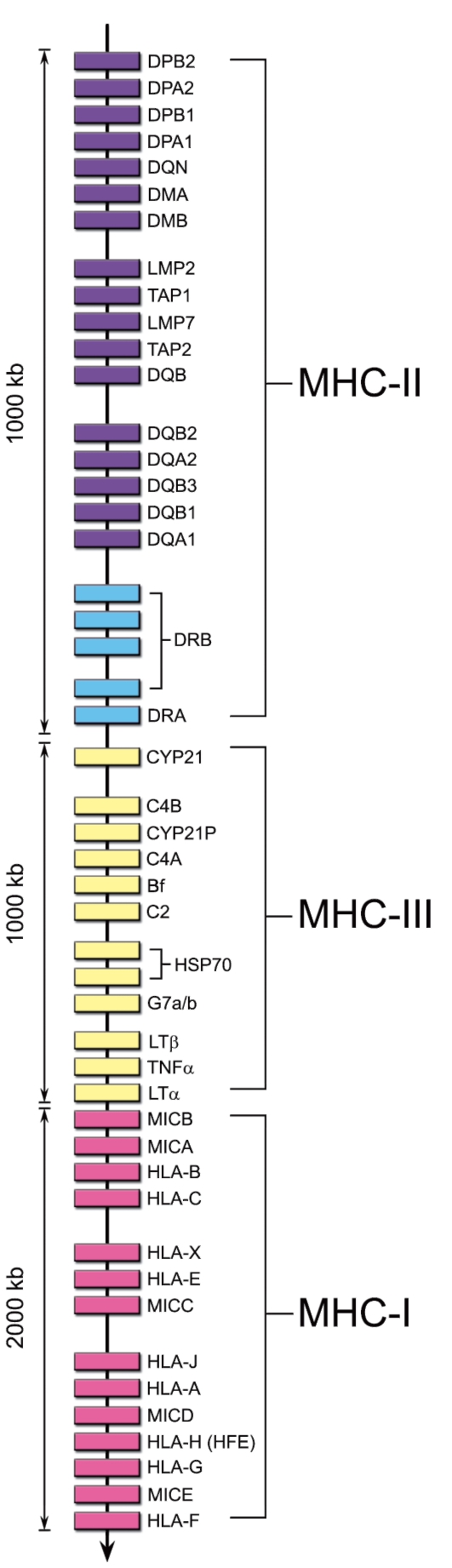
Рис. 7-1. Расположение генов MHC в хромосоме 6 человека
цепи имеет 2 домена. Пептидсвязывающую бороздку формируют совместно α1- и β1-домены. В отличие от аналогичного углубления в составе гликопротеинов MHC-I, пептидсвязывающая щель MHC-II открыта с обеих сторон, что позволяет связывать более длинные пептиды (15-30 аминокислот).
Генетический полиморфизм
Гены комплекса MHC, в отличие от генов TCR и иммуноглобулинов, не подвергаются рекомбинации. Механизм их приспособления к неограниченному множеству потенциальных антигенов заключается в их генетическом полиморфизме (кодоминантность, множественность аллелей, естественный отбор).
• Кодоминантность. Гены MHC кодоминантны, т.е. одновременно экспрессируются гены материнской и отцовской хромосом. Генов MHC-I по 3 (А, В, С) в каждой из гомологичных хромосом, генов MHC-II – также по 3 (DP, DQ, DR). Следовательно, если у матери и отца нет одинаковых аллелей, каждый человек имеет как минимум 12 различных основных аллелей генов MHC.
• Множественность аллелей. Полиморфизм классических генов MHC (классов I и II) означает наличие в популяции множества аллелей – вариантов одноимённого гена у разных особей. Для отдельных локусов MHC известно более сотни аллельных вариантов. Каждый аллельный вариант молекулы MHC преимущественно связывает пептиды с определёнными «якорными» аминокислотными остатками.
• Эволюционный отбор. Каждая особь потенциально способна развить иммунитет только на те пептиды, которые способны связать гликопротеины MHC этой особи. Конкретные варианты MHC закрепляются в эволюции естественным отбором, и каждая отдельная особь оказывается приспособленной к региональным видам и штаммам инфекционных микроорганизмов, на защиту от которых шёл отбор MHC у предков.
• Неклассические гены MHC, видимо, не полиморфны или не столь полиморфны, как гены MHC классов I и II.
Комплексы антигенный пептид-MHC
Формирование комплексов антигенных пептидов с молекулами MHC разных классов происходит в различных клеточных компартментах.
• MHC-I «обслуживают» зону цитозоля, сообщающегося через ядерные поры с содержимым ядра. Здесь происходит фолдинг (принятие правильной конформации) синтезированных белковых молекул. При возникновении ошибок, в том числе и при синтезе вирусных белков, белковые продукты расщепляются в мультипротеазных комплексах (протеосомы). Образующиеся при этом пептиды связываются с молекулами MHC-I. В результате молекулы MHC-I презентируют T-лимфоцитам пептидные антигены, образующиеся внутри клетки. Именно поэтому CD8+ Т-лимфоциты, распознающие комплексы антигенов с MHC-I, участвуют в первую очередь в защите от вирусных, а также от внутриклеточных бактериальных инфекционных заболеваний.
• MHC-II. Зона «обслуживания» MHC-II связана с внеклеточной средой, а также с клеточными органеллами (аппарат Гольджи, эндоплазматический ретикулум, лизосомы, эндосомы и фагосомы). Пептиды, образующиеся в данной зоне, имеют внеклеточное происхождение – это продукты протеолиза белков, захваченных клеткой посредством эндоцитоза. Вновь синтезированные молекулы α- и β-цепей MHC-II с помощью инвариантной полипептидной цепи Ii и кальнексина экспонируются внутрь везикул (эндосом или фаголизосом) и только здесь, связавшись с пептидным антигеном, принимают необходимую конформацию для дальнейшего представления на мембране клетки. Таким образом, молекулы MHC-II презентируют антиген при развитии иммунного ответа на внеклеточные патогены. Главную роль в этом ответе играют CD4+ Т-лимфоциты, распознающие антиген в комплексе с
MHC-II. Суперантигены
В ходе эволюции патогенные микроорганизмы «научились» синтезировать так называемые суперантигены, способные присоединяться к молекулам MHC-II без процессинга и связываться с V-областью Р-цепи TCR. Такое связывание вызывает поликлональную активацию 2-20% периферических CD4+ T-лимфоцитов, что приводит, с одной стороны, к общей интоксикации организма, а с другой – к быстрой гибели активированных T-лимфоцитов путём апоптоза и, следовательно, к иммунодефициту. Например, клиническая картина пищевых отравлений обусловлена главным образом действием энтеротоксинов стафилококков на T-лимфоциты. Иммунодефицит при ВИЧ-инфекции также в
значительной мере объясняется лимфотоксическим действием суперантигенов ВИЧ.
Антигенпрезентирующие молекулы CD1
За пределами MHC имеются гены, кодирующие антигенпрезентирующие молекулы (например, гены кластера CD1, кодирующие CD1a, CD1b, CD1c, CD1d, CD1e). Продукты этих генов – гетеродимеры (состоят из α-цепи и β2-микроглобулина). Они способны связывать и презентировать T-лимфоцитам небелковые антигены – например, миколевую кислоту и липоарабиноманнан оболочки микобактерий. Эти молекулы-гетеродимеры конститутивно экспрессированы на ДК и B-лимфоцитах, а также на тимоцитах и энтероцитах. Антиген в комплексе с CD1 распознают γδT-лимфоциты и NKT-клетки.
АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ
Молекулы MHC контролируют иммунный ответ. Так, MHC-II участвуют в презентации антигенов T-клеткам (рис. 7-3, 7-4) и во взаимодействии T- и B-лимфоцитов. Антигены MHC-I и MHC-II связываются с поверхностными маркёрами Т-клеток: MHC-I с CD8, а MHC-II – с CD4.
• Профессиональные АПК. Молекулы MHC-II экспрессированы только на определённых клетках, которые называют профессиональными АПК. Таких клеток у человека 3 типа: ДК костномозгового происхождения (ДК), B-лимфоциты и макрофаги. На их мембранах, помимо молекул MHC-I и MHC-II, присутствуют все корецепторные молекулы, необходимые для презентации антигена Т-клеткам. Они продуцируют цитокины, необходимые для активации T-лимфоцитов и запуска иммунного ответа.
• Эндотелий тоже может выполнять функции АПК. Вероятно, экспрессия комплексов пептид-MHC на клетках эндотелия служит специфическим сигналом, привлекающим эффекторные лимфоциты из циркуляции в очаг поражения, обеспечивая антигенспецифичный хоминг.
Характеристика разных АПК представлена на рис. 7-2.
Дендритные клетки
Из всех клеток, имеющих определение «дендритные» (что означает «клетки с отростками»), к профессиональным АПК относят только
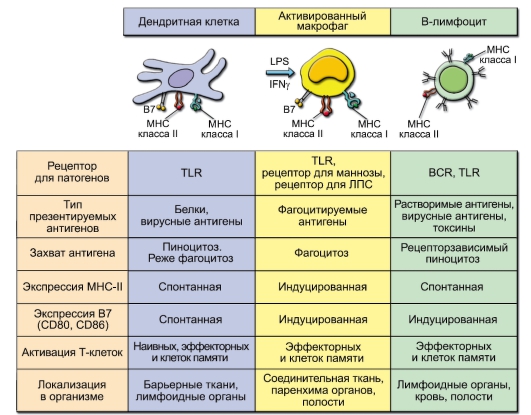
Рис. 7-2. Антигенпрезентирующие клетки. Обозначения: В7 – костимулирующие молекулы (CD80 и CD86)
клетки костномозгового происхождения. Такие клетки широко представлены в организме. Их много в покровных тканях (например, клетки Лангерганса в коже), носоглотке, лёгких, кишечнике и желудке, в крови (незрелые формы) и в лимфоидных органах (зрелые, активированные). Если у B-лимфоцитов и макрофагов есть и иные, причём главные для них, функции – продукция иммуноглобулинов у B-лимфоцитов, фагоцитоз и «переваривание» у макрофагов, – то у ДК нет других функций, кроме презентации антигенов и передачи костимулирующих сигналов лимфоцитам.
• Разновидности ДК: – Миелоидные ДК происходят из моноцитов и экпрессируют маркёр CD11c Их, вероятно, можно рассматривать как разновидность макрофагов, специализирующихся на презентации антигенов T-лимфоцитам.
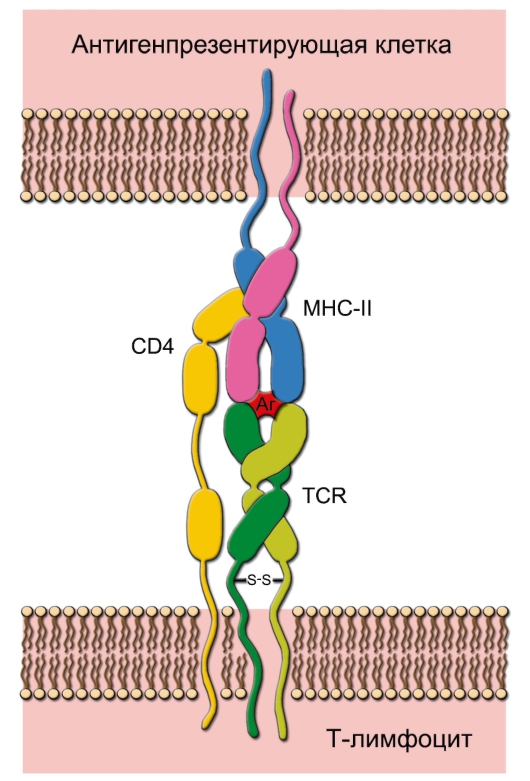
Рис. 7-3. Распознавание антигена рецептором T-лимфоцита. Каждая молекула MHC-II состоит двух цепей – α и β. При помощи TCR T-клетка распознаёт антиген, но только находящийся в комплексе с молекулой MHC. В случае T-хелпера в процессе также участвует CD4, который свободным концом связывается с молекулой MHC. Распознаваемый T-клеткой антиген имеет 2 участка: один взаимодействует с молекулой MHC, другой (эпитоп) связывается с рецептором T-лимфоцита. Подобный же тип взаимодействия, но с участием CD8 характерен для процесса распознавания цитотоксическим T-лимфоцитом антигена, связанного с молекулой MHC-I. Аг – антиген
– Плазмоцитоидные ДК происходят от общей лимфоидной клетки-предшественника, из которой развиваются также T- и B-лимфоциты, NK-клетки. Маркёры предшественников плазмоцитоидных ДК: ИЛ-3Rα (вариант рецептора для ИЛ-3, или CD123), иммуноглобулиноподобные рецепторы – ILT3+ (CD85k) и ILT7+ (CD85g), а также BDCA-2 (CD303), BDCA-3 (CD141) и BDCA-4 (CD304).
• Эндоцитоз. ДК активно и непрерывно поглощают вещества из окружающей среды. При отсутствии патогена ДК поглощают вещества собственных тканей и презентируют этот материал T-лимфоцитам без корецепторного стимула. В результате иммунный ответ в отношении собственных тканей не развивается и поддерживается состояние толерантности к «своему». ДК до активации представлены незрелыми формами, с низкой способностью презентировать антигены Т-лимфоцитам.
• Активация. ДК активируются (созревают) при проникновении патогена в организм и превращаются в зрелые ДК. В распознавании патогена при этом участвует TLR.
– На миелоидных ДК, как и на макрофагах, присутствуют рецепторы для маннозы, ЛПС, а также TLR2 и TLR4, распознающие продукты грамотрицательных и грамположительных бактерий соответственно.
– На плазмоцитоидных ДК присутствуют TLR7 и TLR9 (распознают вирусную и бактериальную ДНК), а также особый лектиновый рецептор, который связывает, например, вирус гриппа.
• Иммунный синапс. Активированные патогеном ДК (зрелые) мигрируют из покровных тканей в региональные лимфоидные органы (в частности, в паракортикальные зоны лимфатических узлов), где презентируют T-лимфоцитам антигены и активируют их через корецепторные молекулы B7.1, B7.2 и CD40. Формирование такого межклеточного – иммунного – синапса (рис. 7-4) – обязательное условие начала развития иммунного ответа.
Взаимодействие T- и В-лимфоцитов
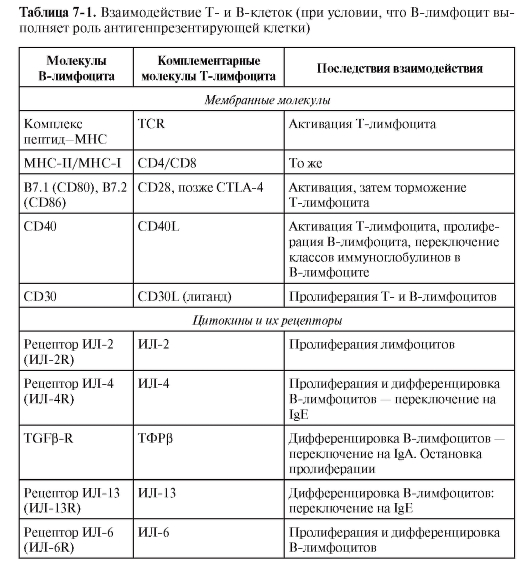
При первичном иммунном ответе единственные эффективные АПК для T-лимфоцитов – ДК. Однако при активации T-лимфоцита антигеном, презентированным ДК, в иммунный ответ будут вовлекаться и рядом расположенные B-лимфоциты, для которых в сложившемся микроокружении тоже найдутся объекты для распознавания. При этом возможны 2 варианта взаимодействия T- и В-лимфоцитов.
• В-лимфоциты через BCR связывают растворимый антиген, поглощают его эндоцитозом, подвергают процессингу и экспонируют на поверхности фрагменты антигена в составе комплексов с молекулами MHC-II. Т-клетка через TCR распознаёт антиген на поверхности B-лимфоцита в комплексе с молекулой МНС-II. Кроме того,
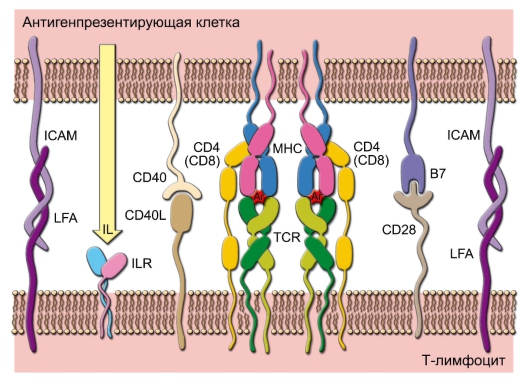
Рис. 7-4. Иммунный синапс между T-лимфоцитом и антигенпрезентирующей клеткой. Минимальный набор взаимодействий, необходимых для начала развития иммунного ответа: связывание агрегированных TCR с комплексами пептид-MHC; связывание корецептора CD4 (или CD8) с MHC; связывание CD40 с CD40L; связывание B7 с CD28; связывание молекул адгезии (ICAM, LFA); взаимодействие цитокинов (IL) с рецепторами для цитокинов (ILR)
устанавливаются все необходимые и достаточные корецепторные взаимосвязи между T- и B-лимфоцитами (табл. 7-1). Такое взаимодействие происходит в T-зависимых зонах периферической лимфоидной ткани в начале развития иммунного ответа. • B-лимфоцит распознаёт специфический антиген, однако недалеко оказывается активированный T-лимфоцит, распознавший антиген на другой АПК. В таком случае взаимодействие Т- и В-лимфоцитов может ограничиться восприятием В-клеткой цитокиновых сигналов от Т-лимфоцита. Взаимодействие же с участием мембранных молекул может наступать или не наступать, по крайней мере, при первичном иммунном ответе. При вторичном иммунном ответе в процесс вовлекаются Т-клетки памяти и обязательно происходит взаимодействие мембранной молекулы B-лимфоцита CD40 с мембранной молекулой T-клетки CD40L. Кроме T-лимфоцитов,
CD40L экспрессируется на тучных клетках, тромбоцитах, макрофагах, естественных киллерах, а также на клетках гладких мышц, эндотелиальных и эпителиальных клетках. Без этого взаимодействия, как показывает опыт, не происходит переключение с IgM на другие изотипы. Вторичный же ответ B2-лимфоцитов характеризуется обязательным переключением изотипа иммуноглобулинов с IgM на IgG, IgA или IgE. Эти взаимодействия Т- и В-клеток происходят уже в B-клеточных зонах – в фолликулах лимфоидных органов.
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ РАЗВИТИЕ РАЗЛИЧНЫХ ТИПОВ ИММУННОГО ОТВЕТА
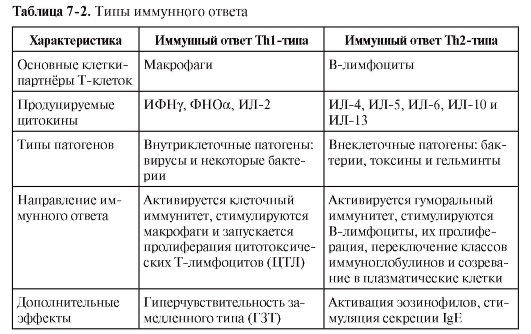
ДК в качестве АПК не только обеспечивают саму возможность развития иммунного ответа или возникновение иммунной толерантности, но и определяют направление дифференцировки хелперных субпопуляций T-лимфоцитов, а значит, тип иммунного ответа (табл. 7-2).
Характер активации АПК зависит от биохимических характеристик и дозы патогена, его биологических свойств и путей попадания в организм. В результате развивается последовательность событий, представленная на рис. 7-5.
Th1-опосредованный или клеточный иммунный ответ
При этом типе иммунного ответа доминирует секреция ИФНу, приводящая к активации макрофагов и стимуляции секреции В-лимфоцитами антител со свойствами опсонинов. Важную роль в Th1-ответе играют ЦТЛ и NK-клетки, что важно не только для противоинфекционного, но и для противоопухолевого и трансплантационного иммунитета.
Биологические эффекты ИФНу направлены на уничтожение клеток, инфицированных вирусами или бактериями:
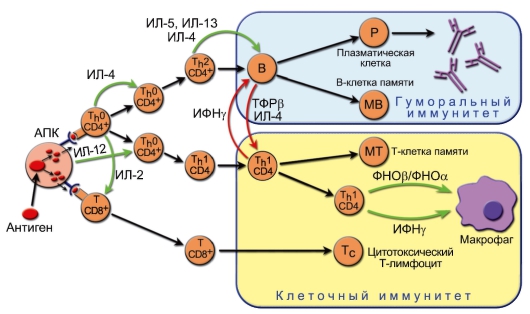
Рис. 7-5. Роль антигенпрезентирующих клеток и Т-хелперов в формировании оптимального варианта иммунного ответа. Этапы: 1 – разные патогены по-разному связываются с разными антигенпрезентирующими клетками, поразному процессируются и по-разному их активируют; 2 – активированные разными способами антигенпрезентирующие клетки продуцируют разные цитокины, воздействующие на T-лимфоциты. Кроме того, концентрации антигена на антигенпрезентирующих клетках могут значительно различаться; 3 – таким образом, направление дифференцировки эффекторного T-лимфоцита определяют и антиген, и цитокиновый сигнал от антигенпрезентирующих клеток; 4 – дифференцированные эффекторные T-лимфоциты начинают продуцировать определённый набор цитокинов, определяющий различные типы иммунного ответа. Перекрёстная регуляция: ИФНγ, образуемый Th1-клетками, подавляет пролиферацию Th2-лимфоцитов. В свою очередь, ИЛ-10, продуцируемый Th2клетками, подавляет образование Th1-цитокинов. Зелёные стрелки – активационные сигналы, красные – ингибиторные
• индукция противовирусного действия на уровне ферментов, расщепляющих нуклеиновые кислоты (2′,5′-олигоаденилатсинтетазы и др.);
• сильная стимуляция макрофагов, соответственно повышенный синтез этими клетками токсичных продуктов;
• стимуляция NK-клеток;
• поддержание переключения синтеза иммуноглобулинов в B-лимфоцитах на IgG, что активирует фагоциты (нейтрофилы и макрофаги), т.е. T-лимфоциты как продуценты интерферона обе-
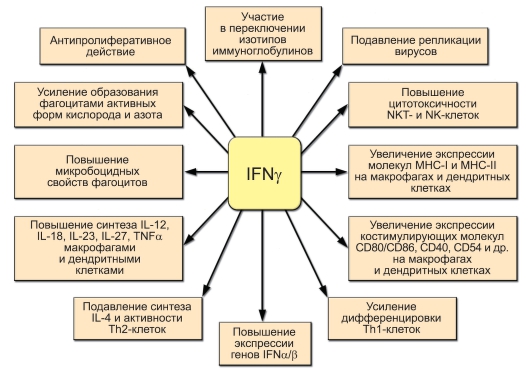
Рис. 7-6. Основные функции IFNy
спечивают макрофагальный и цитотоксический характер иммунного ответа.
Основные функции IFNy представлены на рис. 7-6.
Условия развития иммунного ответа Th1-типа
• Зрелые ДК осуществляют контроль за Т-клеточной дифференцировкой в зависимости от типа патогена, пути заражения, наличия сигналов от клеток врождённого иммунитета и тканевых факторов. В случае контакта с внутриклеточными бактериями, вирусами или паразитами миелоидные ДК, вступив в контакт с Т-лимфоцитами лимфатических узлов, начинают продуцировать ИЛ-12 и ФНОα, стимулируя T-лимфоциты к выработке ИФНγ. ИЛ-12 продуцируют также макрофаги и нейтрофилы.
• На T-лимфоците, TCR которого связал антиген с высокой авидностью, устойчиво экспрессируется рецептор для ИЛ-12, содержащий β2-субъединицу (экспрессия этой субъединицы специфична именно для Th1).
• Плазмоцитоидные ДК сразу после распознавания патогена (ещё до попадания в лимфатический узел) начинают активно продуцировать интерфероны типа I (ИФНα и ИФНβ), которые, с одной стороны, аутокринно стимулируют созревание ДК, с другой – индуцируют образование T-лимфоцитами ИФНγ и ИЛ-10, а не одного только ИФНγ, как ИЛ-12 миелоидных ДК. ИЛ-10 подавляет дифференцировку и активность Th1-лимфоцитов, возможно, не напрямую, а через угнетение активности макрофагов и возникающий при этом недостаток ИЛ-12.
• ИФНγ и ИФНα – кофакторы для дифференцировки Th1лимфоцитов, индуцируемой ИЛ-12. Их источником, помимо Th1-клеток, служат активированные CD8+ T-клетки, т.е. CD8+ Т-лимфоциты вносят свой вклад в дифференцировку CD4+ T-клеток по пути Th1.
• В свою очередь, Th1-хелперы стимулированные ДК, активируют цитотоксические CD8+ Т-лимфоциты и макрофаги, которые «расправляются» с клетками организма, заражёнными внутриклеточными патогенами.
Таким образом, большая нагрузка антигеном и достаточные количества ИЛ-12 – необходимые и, возможно, достаточные условия для индукции дифференцировки T-лимфоцитов в продуценты ИФНγ, т.е. CD4+ Th1-лимфоциты.
Th2-опосредованный или гуморальный иммунный ответ
• Иммунный ответ Th2-типа контролируется другими цитокинами, чем Th1-ответ, – в основном ИЛ-4. Продуценты ИЛ-4 – CD4+ Тh2-клетки, дважды негативные CD4–CD8– T-лимфоциты, тучные клетки. Этот тип ответа направлен на стимуляцию В-лимфоцитов к образованию антител, нейтрализующих бактерии, токсины, паразитов и реализующих другие эффекты гуморального иммунитета.
• Th2-лимфоциты поддерживают переключение синтеза изотипов иммуноглобулинов в B-лимфоцитах на IgE, IgG4 и IgА. Клеткипартнёры для этих изотипов – тучные клетки, базофилы и эозинофилы. При их активации развиваются воспалительные процессы с выраженным вазоактивным компонентом и экссудацией или характерное эозинофильное воспаление.
• За исключением патологических случаев IgE-зависимых аллергических реакций иммунный ответ Th2-типа принято (достаточно условно) рассматривать как противовоспалительный.
Условия развития иммунного ответа Th2-типа
Этот вариант иммунного ответа направлен на «перехват» растворимых компонентов патогенов (токсинов, аллергенов, химиопрепаратов), опсонизацию и фагоцитоз бактерий и вирусов, а также на элиминацию крупных инвазивных патогенов – гельминтов, которые не могут быть фагоцитированы макрофагами из-за своих размеров. При этом активация цитотоксических лимфоцитов не сообразна, и приоритет получает стимуляция B-лимфоцитов к продукции антител. Лидирующая роль в дифференцировке Т-хелперов в направлении Th2 отводится плазмоцитоидным ДК.
Интерлейкин-4 (ИЛ-4)
• СD4+ Т-лимфоциты, не получившие стимула от ИЛ-12, экспрессируют молекулу OX40. Лигандом для неё служит OX40L на мембране активированных ДК и B-лимфоцитов.
• Взаимодействие OX40-OX40L индуцирует образование T-лимфоцитами ИЛ-4 и экспрессию на В-клетках CXCR5 (рецептор для хемокина CXCL13), обеспечивающего миграцию этих В-лимфоцитов в лимфоидные фолликулы лимфатического узла, т.е. в B-клеточную зону, где происходят дальнейшие Т/B-взаимодействия.
• ИЛ-4 и ИЛ-13 аутокринно стимулируют дифференцировку наивных CD4+ T-лимфоцитов в Th2-клетки.
Интерлейкин-5 (ИЛ-5)
• При физиологическом иммунном ответе на антигены, в частности, связанные с гельминтами, Th2-лимфоциты и тучные клетки продуцируют ИЛ-5.
• ИЛ-5 поддерживает дифференцировку эозинофилов и активирует зрелые эозинофилы. Это единственный известный эффекторный механизм, направленный на уничтожение гельминтов, проникших в ткани внутренней среды организма.
Кишечных гельминтов организм «изгоняет» также с участием IgE, индуцирующего дегрануляцию тучных клеток в слизистой оболочке кишки. Выбрасываемый в ткани гистамин инициирует сокращение гладких мышц стенки кишки, т.е. активную перистальтику и выброс гельминтов. Кроме того, цитокины, ассоциированные с Th2-ответом
(ИЛ-4, ИЛ-9, ИЛ-13, ИЛ-25 и ИЛ-33), вызывают активацию эпителиальных клеток кишечника и усиление выработки слизи.
Апоптоз. Для Th2-лимфоцитов характерна экспрессия ещё одной мембранной молекулы – CD30. Взаимодействие её с лигандом CD30L, экспрессированным на B-лимфоцитах, эозинофилах, эпителии мозговой зоны тимуса и клетках-предшественницах миелопоэза в костном мозге, сначала повышает активность T-лимфоцита, а затем индуцирует его апоптоз.
Иммунное отклонение
В условиях нормы дифференцировка Th1- и Th2-клеток определяется функциональными запросами, так как АГ, индуцирующие иммунный ответ, как правило, обеспечивают его развитие в направлении формирования тех типов эффекторных клеток, которые (сами по себе или через гуморальные продукты) участвуют в реализации протективного эффекта.
Направление терминальной дифференцировки наивных CD4+ T-лимфоцитов в сторону преобладания той или иной субпопуляции (Th1 или Th2) в процессе развития иммунного ответа называют иммунным отклонением.
Нарушение баланса активности Th1- и Th2-субпопуляций играет определяющую роль в развитии многих заболеваний. Несбалансированное преобладание эффектов Th1-клеток означает гиперпродукцию ИФНу и других цитокинов, способствующих развитию иммунного воспаления, которое является основой клеточной аутоиммунной патологии – органоспецифических и некоторых системных аутоиммунных процессов. Преобладание влияния Th2-клеток приводит к гиперпродукции ИЛ-4, ИЛ-5, ИЛ-13 и других цитокинов, способствующих развитию аллергической реакции немедленного типа через влияние на выработку IgE-антител, дифференцировку тучных клеток и эозинофилов. Подходы к коррекции Th1/Th2 дисбалансов основаны на воздействиях, оппозитных преобладающему типу цитокинов: при избыточном количестве Th1-факторов необходимо воздействовать цитокинами, продуцируемыми Th2-клетками, или антителами к Th1цитокинам или их рецепторам. Преобладание Th2-цитокинов требует противоположных воздействий.
Патологические процессы с превалированием иммунного ответа типа Th1 или Th2 перечислены ниже.
• Th1 (макрофагальное воспаление – ГЗТ, гранулемы): тиреоидит Хасимото, офтальмопатия, сахарный диабет 1-го типа, рассеянный склероз, ревматоидный артрит, гастрит (возбудитель Helicobacter pylori), боррелиоз Лайма, хронический гепатит С, острое отторжение аллотрансплантата, острая болезнь «трансплантат против хозяина», саркоидоз, апластическая анемия, привычные аборты.
• Th2 (Тh2-зависимое воспаление – экссудативное, эозинофильное и др.): корь, синдром Оменна, атопические заболевания; хроническая болезнь «трансплантат против хозяина»; аллергический кератоконъюнктивит.
Глава 8. ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ ИММУНИТЕТА
Эффекторные механизмы иммунитета направлены на связывание и элиминацию патогенов.
Существует 2 типа антигенсвязывающих рецепторов. В связи с этим выделяют 2 типа эффекторных механизмов.
• Антителозависимый, или гуморальный иммунитет. Осуществляется за счёт гуморальных (растворимых) факторов – антител, связывающих антиген и удаляющих его с использованием ряда механизмов: преципитации, агглютинации, нейтрализации, лизиса, блокады и опсонизации.
• Опосредованный клетками (антителонезависимый), или клеточный иммунитет. Клеточный иммунитет реализуется за счёт клеток иммунной системы, в первую очередь Т-лимфоцитов, а также активированных макрофагов и NK-клеток, непосредственно разрушающих генетически чужеродные клетки или инфицированные вирусами и другими внутриклеточными патогенами, и опухолевые клетки.
АНТИТЕЛОЗАВИСИМЫЕ МЕХАНИЗМЫ ЗАЩИТЫ
Опсонизация и запуск системы комплемента
Само по себе связывание антител с антигеном является защитным, по крайней мере, в двух случаях:
• если антиген – сильный яд, антитело при связывании нейтрализует его токсичность;
• если антиген представлен на поверхности патогена (вирус, прион, бактерия), антитело, связав его, препятствует распространению патогена в организме.
Однако в этих случаях защитная реакция не заканчивается на образовании макромолекулярных комплексов антиген-антитело. Эти комплексы необходимо расщепить до мелких метаболитов. Это происходит
при связывании образовавшихся иммунных комплексов с компонентами комплемента. Способность связывать комплемент у иммуноглобулинов разных классов различается (IgM > IgG3 > IgG1). Комплексы антиген-антитело-компоненты комплемента транспортируются эритроцитами, имеющими рецепторы для компонентов комплемента, в синусоиды селезёнки и печени, где их фагоцитируют и расщепят макрофаги.
Fc-рецепторы
Fc-рецепторы (FcR) – семейство мембранных рецепторов клеток иммунной системы, главной функцией которой является распознавание и связывание Fc-фрагмента иммуноглобулинов, находящихся в свободном состоянии и в составе иммунного комплекса. FcR, наряду с TCR и BCR, можно отнести к иммунорецепторам, поскольку клетка-носитель FcR способна связать антиген (пусть и посредством антител) и отвечать на него. FcR выявлены не только на лимфоцитах, но и на всех известных лейкоцитах.
Типы и разновидности FcR. По изотипу связываемых тяжёлых цепей иммуноглобулинов выделяют 4 разновидности FcR: γ, ε, α, μ; а по аффинности связывания с лигандом – 3 типа FcR: I, II и III. FcR типа I способны связывать свободные молекулы антител (это особенно характерно для IgE), FcR типов II и III – только комплексы антиген- антитело.
Fcγ-рецепторы (FcγR) различаются по строению и сродству к Fcчасти IgG, а также специфичности к различным подклассам IgG (рис. 8-1). FcγRI содержит в своём составе 2 полипептидные цепи, из которых α-цепь отвечает за связывание IgG, а γ-цепь – за передачу сигнала (эту функцию осуществляет внутриклеточный γ-домен). Рецепторы типа FcyRII образованы единственной цепью. В зависимости от структуры их внутриклеточной части различают две разновидности этих рецепторов – FcγRIIA и FcγRIIB. В первом случае во внутриклеточной части содержится γ-домен, во второй – последовательность ITIM (Immunoreceptor-Tyrosin-based Inhibitory Motif – тирозинсодержащие ингибирующие последовательности аминокислот в иммунорецепторах). Эти особенности определяют функцию рецепторов: FcγRIIA передаёт стимулирующий, а FcγRIIB – ингибирующий сигнал. FcγRIII тоже существует в двух вариантах. Вариант FcγRIIIA, подобно FcγRI, содержит IgG-связывающую α- и сигнальную γ- (или ζ-) цепи. FcγRIIIB не
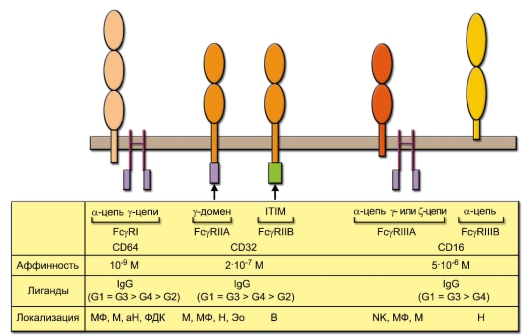
Рис. 8-1. Строение и свойства основных разновидностей Fcγ-рецепторов. Овальными символами обозначены домены, принадлежащие к суперсемейству иммуноглобулинов; ITIM – ингибирующая последовательность иммунорецепторов, содержащая тирозин. В нижней части рисунка в строке «Лиганды» в скобках представлены подклассы IgG, расположенные по убыванию их сродства к данному типу FcγR. Клетки, на которых локализуются Fcγ-рецепторы: Н – нейтрофил, аН – активированный нейтрофил, М – моноцит, МФ – макрофаг, Эо – эозинофил, NK – NK-клетка, В – В-лимфоцит, ФДК – фолликулярная дендритная клетка
обладает сигнальной функцией: его единственная a-цепь заякорена в фосфолипидный слой мембраны и лишена цитоплазматической части. Внеклеточные домены a-цепей рецепторов и единственных цепей FcγRII относятся к суперсемейству иммуноглобулинов.
Известны две разновидности Fcε-рецепторов, отличающиеся по структуре, сродству к Fc-части IgE и по биологической роли (рис. 8-2). FcεI-рецептор построен аналогично FcγRIIIA, но имеет дополнительную β-цепь, четырёхкратно пронизывающую мембрану. Этому рецептору принадлежит основная роль в запуске дегрануляции тучных клеток (ТК) – ключевого события в развитии реакций гиперчувствительности немедленного типа. FcεII-рецептор структурно не имеет сродства к FcεI-рецептору. Он играет роль в регуляции синтеза IgE, а также в регу-
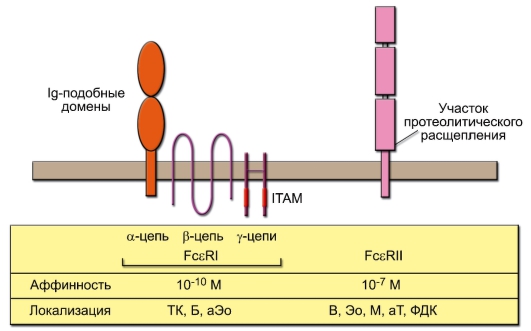
Рис. 8-2. Строение и свойства Fcε-рецепторов. Овальными символами обозначены домены, принадлежащие к суперсемейству иммуноглобулинов; ITAM – активационная последовательность иммунорецепторов, содержащая тирозин. Клетки, на которых локализуются Fcε-рецепторы: ТК – тучная клетка; Б – базофил, М – моноцит, Эо – эозинофил, В и Т – В- и Т-лимфоциты соответственно, ФДК – фолликулярная дендритная клетка. Буква «а» обозначает активированные клетки
ляции роста и дифференцировки В-лимфоцитов. FcεII-рецептор также существует в виде секретируемой формы, играя роль цитокина с широким спектром действия.
Fcα-рецептор структурно сходен с рецепторами FcγRIIIA и FcεIR, его α-цепь принадлежит к суперсемейству иммуноглобулинов (рис. 8-3). Функция этого рецептора практически не изучена.
Рецептор Poly-IgR предназначен для транспорта полимерных иммуноглобулинов (IgA, IgM) через стенку слизистых оболочек. Его фрагмент, связанный с этими молекулами, обозначают как секреторный компонент (SC).
Неонатальный рецептор FcγRn (n – neonatal) отвечает за транспорт IgG, поступающего в кишечник ребёнка с молозивом или молоком, а затем – через кишечную стенку в кровоток ребёнка. Он также отвечает за трансплацентарный транспорт IgG. По структуре он аналогичен молекулам МНС-I (см. рис. 5-1) и содержит в своем составе β2-микроглобулин,
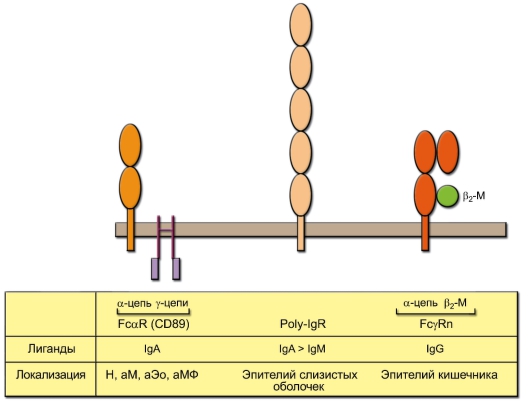
Рис. 8-3. Fcα-рецептор и Fс-рецепторы, ответственные за транспорт иммуноглобулинов. Клетки, на которых локализуются Fcγ-рецепторы: Н – нейтрофил, М – моноцит, МФ – макрофаг, Эо – эозинофил. Буква «а» обозначает активированные клетки
нековалентно связанный с α-цепью. Кроме того, FcγRn повышает срок жизни IgG в организме, защищая его от деградации в эндосомах.
На рис. 8-4 схематично представлены основные пути передачи сигналов с FcR. При перекрестном связывании FcR с лигандом (например, опсонизированным микроорганизмом) ITAM-мотив γ-цепи или α-цепи FcγRIIA фосфорилируется Src-киназами. Это приводит к взаимодействию SH2-доменов Syk-киназы с ITAM-мотивом FcR, его активации и фосфорилированию Scr-киназами. Активированная Syk-киназа фосфорилирует адапторный белок SLP-76, вовлекая в сигнальный процесс белок Vav из семейства GEF (Guanine nucleotide Exchange Factor). Он активирует ГТФазу Rac и адапторный белок ADAP, что вызывает реорганизацию актина, необходимую для образования фагоцитарной чаши и поглощения микроорганизма. С помощью адаптора SLP-76 фосфо-
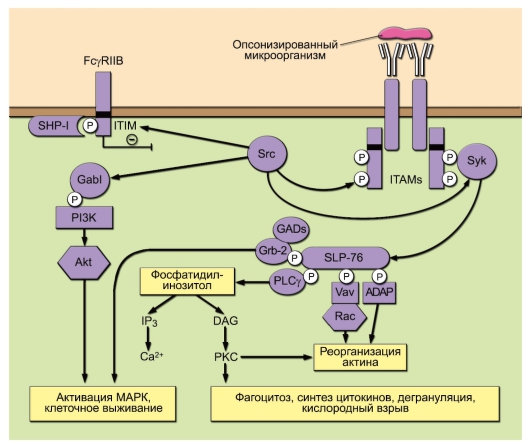
Рис. 8-4. Сигнальные пути, идущие от Fc-рецептора. Пояснения см. в тексте
рилируется фосфолипаза С (PLCγ), расщепляющая фосфатидилинозитол на инозитолтрифосфат (IP3; активатор Са2+) и диацилглицерол (DAG) – активатор протеинкиназы С (PKC). Эти события определяют развитие процессов поглощения антигена, дегрануляции и кислородного взрыва. Src-киназы через адапторный белок Gab1 фосфорилируют фосфоинозитид-3-киназу (PI3K), активируя белок Akt, киназу МАР и поддерживают выживание клеток – ингибирование апоптоза. Srcкиназы также могут инициировать ингибиторный путь. В покоящейся клетке фосфатазы SHP-1 или SHIP-1 ассоциированы с ITIM-мотивом. Фосфорилирование ITIM-мотива приводит к активации фосфатаз. Последние дефосфорилируют активированные ферменты и адапторные белки и прерывают развитие сигнального пути.
Антителозависимая клеточная цитотоксичность
Феномен АнтителоЗависимой Клеточной ЦитоТоксичности (АЗКЦТ) проявляется, когда антитело связывает антиген на поверхности какой-либо клетки-мишени и через Fc-фрагмент привлекает для ее разрушения эффекторные клетки (NK-клетки, макрофаги, эозинофилы и др.).
• Естественные киллеры. NK-клетки имеют рецептор (FcγRIII) для
Fc-фрагментов IgG. Механизм собственно киллерного действия NK-лимфоцитов на клетку-мишень такой же, как и киллерный механизм ЦТЛ – перфорин-гранзимовый (см. рис. 1-4 и рис. 6-4).
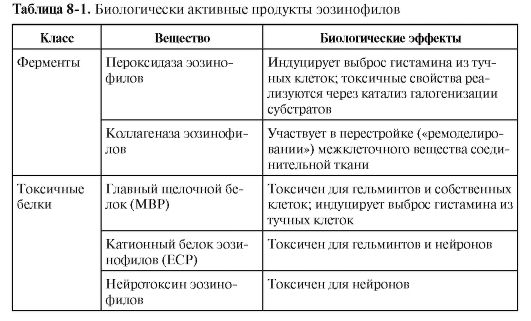
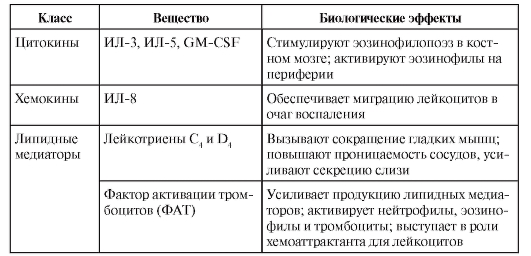
• Эозинофилы. Механизм санации от гельминтов – вариант антителозависимой клеточной цитотоксичности, где в качестве эффекторных клеток выступают эозинофилы, имеющие низкоаффинные рецепторы для IgE – FcεRII и для IgA – FcαRII. Связывание этих рецепторов с лигандами в сочетании с сигналом от цитокина ИЛ-5 стимулирует синтез и секрецию эозинофилом высокотоксичных белков, направленных на уничтожение гельминтов. Другими словами, активированный эозинофил секретирует ряд биологически активных веществ, действие которых объясняют симптоматику так называемых эозинофильных воспалительных процессов (табл. 8-1).
Гиперчувствительность немедленного типа
Сосудистые и миоконстрикторные реакции, опосредованные медиаторами тучных клеток и базофилов, приводят к развитию гиперчувствительности немедленного типа (ГНТ). Цитокины тучных клеток и базофилов поддерживают иммунный сдвиг в дифференцировке субпопуляций CD4+ T-лимфоцитов в сторону Th2 (ИЛ-4, ИЛ-13), а также поддерживают дифференцировку и активацию эозинофилов (ИЛ-5, ИЛ-3, GM-CSF). В случае патологии именно эти клетки (Th2, тучные клетки, базофилы, эозинофилы) и IgE составляют самоподдерживающийся ансамбль, ответственный за реакции ГНТ. Мишени для цитокинов – клетки гладкой мускулатуры и эндотелия (следовательно, сосуды, бронхи, органы пищеварения). Системная реакция ГНТ – анафилактический шок.
Базофильные лейкоциты и тучные клетки. В этих реакциях антитела вовлекают в ответ базофилы и тучные клетки. Существенные функциональные признаки этих клеток схожи: наличие на мембране высокоаффинного рецептора для IgE (FcεRI) и одинаковый набор биологически активных медиаторов.
• Тучные клетки локализованы в соединительной ткани собственного слоя слизистых оболочек (laminapropria mucosae), в подкожной соединительной ткани и соединительной ткани, расположенной по ходу всех кровеносных сосудов. Выделяют, по крайней мере, 2 тканевые разновидности тучных клеток.
– Тучные клетки слизистых оболочек из сериновых протеаз экспрессируют триптазу и химазу, секретируют минимум гистамина; из протеогликанов в них преобладает хондроитинсульфат; из метаболитов арахидоновой кислоты – лейкотриен C4 (LTC4). По-видимому, дифференцировка этих клеток зависит от T-лимфоцитов, а именно от местной стимуляции клеток-предшественников цитокином ИЛ-3.
– Тучные клетки соединительной ткани локализованы в серозных оболочках полостей тела и в лёгких. Из сериновых протеаз экспрессируют преимущественно триптазу, из протеогликанов – гепарин, секретируют много гистамина, из метаболитов арахидоновой кислоты в них преобладает простагландин D2. Дифференцировку этих тучных клеток стимулируют фибробласты.
• Базофилы циркулируют в крови и мигрируют в ткани только в очаг воспаления (как нейтрофилы). На базофилах экспрессированы молекулы адгезии, важные для хоминга в очаг: LFA-1 (CD11a/CD18), Mac-1 (CD11b/CD18), CD44.
Активация. Сигналы, активирующие как тучные клетки, так и базофилы.
• Гомотипная агрегация FceRI. Клетки активируются комплексом IgE с антигеном или антителами к рецептору. FceRI способен связывать свободные IgE-антитела – до того, как они свяжут свой антиген. Клетки с комплексом IgE-FceRI на мембране тучных клеток находятся в состоянии готовности в считанные секунды и минуты осуществить дегрануляцию в ответ на распознавание поступившего антигена (рис. 8-5). Ход событий: антиген взаимодействует с Fabфрагментами IgE и активированная этим сигналом тучная клетка подвергается дегрануляции.
• Анафилатоксины – фрагменты компонентов системы комплемента, образующиеся при развитии каскада.
• Медиаторы из активированных нейтрофилов.
• Нейромедиаторы (норадреналин, вещество Р).
Медиаторы тучных клеток и базофилов различны по биохимическим свойствам, по предназначению и по срокам выброса из активированной клетки. Медиаторы, депонируемые в гранулах, первыми выбрасываются из клетки в ответ на активирующий сигнал. Другие медиаторы синтезируются de novo и вступают в процесс позже.
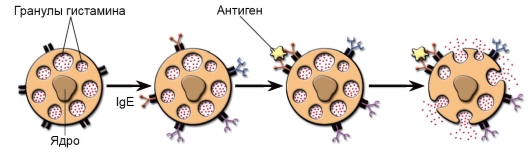
Рис. 8-5. Дегрануляция тучных клеток
• Гистамин. На разных клетках есть разные рецепторы для гистамина – Н1, Н2 и Н3. Гистамин проявляет вазоактивные эффекты: вызывает констрикцию эндотелиальных клеток, контакты между эндотелиоцитами становятся менее плотными, и сыворотка выходит из сосуда в ткани; стимулирует синтез в клетках эндотелия простациклина и радикала оксида азота (NO’), вызывающих расслабление гладких мышц сосудистой стенки и, следовательно, вазодилатацию.
– Если процесс происходит в коже, клинически он проявляется в виде волдырей и покраснения (крапивница). В случае аллергической патологии снять симптомы помогают лекарственные средства – блокаторы Н1-рецепторов гистамина.
– При выделении достаточно большого количества гистамина он вызывает клинически значимые сокращения гладких мышц кишечника (перистальтику) и бронхов (бронхоспазм), однако этот эффект непродолжителен, поскольку гистамин быстро распадается во внеклеточной среде.
• Липидные медиаторы. При стимуляции тучных клеток в них активируются ферменты метаболизма липидов, а именно фосфолипаза А2. Этот фермент участвует в образовании биологически активных медиаторов, используя в качестве субстратов фосфолипиды клеточных мембран и липиды (в первую очередь арахидоновую кислоту).
– Простагландин D2 – действует как вазодилататор и бронхоконстриктор. В биосинтезе простагландина D2 из арахидоновой кислоты участвует циклооксигеназа. Фармакологическим ингибитором этого фермента является ацетилсалициловая кислота.
– Лейкотриены (LTC4, LTD4, LTE4) – альтернативные продукты метаболизма арахидоновой кислоты, образуемые под воздей-
ствием 5-липооксигеназы. Комплекс лейкотриенов – медленно реагирующий компонент анафилаксии. Именно он в наибольшей мере ответственен за бронхоконстрикцию при бронхиальной астме. Это объясняет усугубление астматических приступов ацетилсалициловой кислотой: блокируя синтез простагландина D2, ацетилсалициловая кислота высвобождает метаболический шунт арахидоновой кислоты в пользу лейкотриенов.
– Фактор активации тромбоцитов (ФАТ) вызывает бронхоконстрикцию, а также релаксацию гладких мышц сосудов и ретракцию эндотелия. ФАТ продуцируют не только (а может быть, и не столько) тучные клетки, но и клетки эндотелия, стимулированные гистамином и лейкотриенами.
– Ферменты тучных клеток и базофилов [сериновые протеазы (триптаза и химаза), катепсин G, карбоксипептидаза] способствуют перестройке матрикса соединительной ткани.
– Цитокины тучных клеток и базофилов. К ним относят интерлейкины, GM-CSF и др.
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ, ОПОСРЕДОВАННЫЕ КЛЕТКАМИ
Антителонезависимые эффекторные механизмы иммунитета в первую очередь реализуют ЦТЛ. К ним относят CD8+ Tαβ-лимфоциты и NKT-клетки – лимфоциты, одновременно экспрессирующие рецепторы NK- и Т-клеток. Есть T-киллеры и среди Tγδ-лимфоцитов.
Главное назначение ЦТЛ – санация организма от внутриклеточных патогенов, опухолевых и других изменённых клеток, реализуемая киллерной функцией ЦТЛ и цитокинами.
• Киллерная функция. ЦТЛ осуществляют киллерную функцию (см. рис. 1-5 и рис. 6-7) с помощью особых белков – цитотоксинов, к которым относят перфорин, гранзимы и недостаточно изученный цитолизин.
– Синтез цитотоксинов происходит de novo после вовлечения ЦТЛ в иммунный ответ и распознавания ими специфичного антигена.
– Накопление цитотоксинов. В виде функционально неактивных молекул-предшественников цитотоксины накапливаются в гранулах, сконцентрированных в клетке вблизи TCR.
– Дегрануляция ЦТЛ происходит в области межклеточного контакта, образующегося при связывании TCR с антигеном на по-
верхности клетки-мишени. Этот процесс облигатно зависит от
Ca2+.
– Перфорин накапливается в гранулах в виде растворимого предшественника. При высвобождении из гранул и в присутствии Ca2+ перфорин быстро полимеризуется в мембране клетки-мишени, образуя цилиндрическую структуру. При этом липофильные участки молекул перфорина ориентируются в сторону клеточной мембраны, а гидрофильные – в сторону канала внутрь клетки. В результате образуется пора диаметром около 16 нм.
– Гранзимы и апоптоз. Через пору, образованную перфорином, внутрь клетки-мишени попадают выделенные ЦТЛ-гранзимы. Охарактеризовано 3 гранзима ЦТЛ – А, В и С. Это специализированные сериновые протеазы, субстратами которых служат ферменты, инициирующие в клетке-мишени программу апоптоза. При этом происходит разрушение ДНК и белков клетки, а в случае, если она поражена вирусом, то и инфицировавшего её патогена.
– Лизис мишени. Если механизмы апоптоза клетки-мишени по какой-либо причине нарушаются, ЦТЛ всё равно разрушает клетку путём осмотического лизиса через сформированные перфорином поры. Однако в этом случае неповреждённые вирусные частицы и нуклеиновые кислоты могут инфицировать другие клетки, что и происходит в случае некоторых инфекционных заболеваний.
• Цитокины. CD8+ ЦТЛ продуцируют цитокины – ИФНγ, ФНОα и ФНОβ (лимфотоксин). Эффекты ИФНγ перечислены ниже:
– непосредственно подавляет репликацию вирусов;
– индуцирует в клетках-мишенях повышенную экспрессию молекул MHC-I и MHC-II, способствуя более эффективной презентации вирусных антигенов T-лимфоцитам: и для распознавания, и для киллинга;
– активирует макрофаги и NK-клетки;
– служит кофактором при индукции дифференцировки наивных CD4+ T-лимфоцитов в Th1-клетки. Это означает, что CD8+ ЦТЛ вносят вклад в развитие других эффекторных механизмов иммунного ответа – с участием Th1-лимфоцитов.
ГИПЕРЧУВСТВИТЕЛЬНОСТЬ ЗАМЕДЛЕННОГО ТИПА
Гиперчувствительность замедленного типа (ГЗТ) – воспаление тканей, «организуемое» CD4+ T-лимфоцитами субпопуляции Th1 – продуцентами ИФНу. Клетками-исполнителями служат активированные макрофаги. Если в очаге инфекции происходит активация макрофага CD4+ Th1-лимфоцитом, микробицидные возможности макрофага существенно увеличиваются, и он более эффективно разрушает поглощённые патогены. К сожалению, в макрофаге погибают не все патогены, особенно жизнеспособны вирусы, например ВИЧ, а также микобактерии.
Активация макрофага. Для активации макрофага необходимы 2 типа воздействия со стороны лимфоцитов:
• контактное – молекула CD40L на Thl-лимфоците связывается с молекулой CD40 на макрофаге;
• цитокиновое – ИФНγ, продуцируемый Th1-клеткой, CD8+ ЦТЛ или NK-клеткой, связывается с рецептором на макрофаге;
• инфицированный макрофаг имеет больше шансов вступить во взаимодействие с Th1-клеткой, что обусловлено распознаванием Т-клеткой антигена на поверхности макрофага. В результате именно этот макрофаг получит активирующие сигналы от Т-клетки через интерферон и CD40L.
Ингибитор активации макрофагов – ИЛ-10.
Характеристики активированного макрофага. Макрофаг, активированный взаимодействием с Th1-клеткой, приобретает следующие признаки и функциональные способности.
• Увеличивается число рецепторов FcγR, при помощи которых макрофаг связывает комплексы антиген-антитело и фагоцитирует их.
• ИФНу в макрофагах индуцирует биосинтез ферментов, образующих радикалы активных форм кислорода, которые окисляют фагоцитированный антиген.
• В макрофагах под действием ИФНγ, ФНОα и, возможно, ИЛ-1 индуцируется экспрессия NO-синтазы, продуцирующей радикал NO*, который тоже окисляет фагоцитированный материал.
• В макрофагах индуцируется синтез липидных медиаторов воспаления – ФАТ, простагландинов и лейкотриенов (LTE4).
• Макрофаг синтезирует тканевой фактор коагуляции. В начавшемся процессе коагуляции активируется сывороточный тромбин – протеаза, стимулирующая клетки эндотелия сосудов, а также
нейтрофилы к синтезу ФАТ, что ещё больше способствует прогрессированию воспалительного процесса.
• ИФНγ служит самым сильным из известных индукторов синтеза и экспрессии молекул MHC-II. Кроме того, на активированных макрофагах, в отличие от неактивированных, индуцируется экспрессия костимуляторной молекулы B7, что делает активированные макрофаги более эффективными АПК. А также на активированных макрофагах возрастает экспрессия молекул адгезии ICAM-1 и LFA-3.
• Активированные макрофаги продуцируют ИЛ-12, способствующий дифференцировке Th1-лимфоцитов.
Очаг воспаления. Цитокины активированных макрофагов – ФНОа, ИЛ-1 и хемокины – создают очаг воспаления в виде плотных на ощупь узелков разного размера (симптом индурации). Плотность очага обусловлена выпотом из сосудов фибриногена и полимеризацией его в фибрин. Среди клеток, присутствующих в очаге, в первые 6-8 ч преобладают нейтрофилы, затем макрофаги и Th1-лимфоциты. Плотность клеток в свежем очаге ГЗТ невелика.
Сроки развития реакции. ГЗТ получила такое название, поскольку между моментом проникновения антигена в ткань и развитием характерного очага плотного воспаления проходит не менее 24-48 ч. После связывания антигена Th1-клетке требуется примерно 1 ч для индукции биосинтеза цитокинов, а также для синтеза и экспрессии на мембране молекулы CD40L.
Эффекты факторов роста. Среди цитокинов, продуцируемых активированными макрофагами, присутствуют факторы роста, что может значительно изменить состояние прилегающих к очагу тканей. Стандартная защитная реакция – развитие очага воспаления по типу ГЗТ, однако в патологических случаях цитокины, выделяемые активированными макрофагами, вызывают фиброзное перерождение тканей: тромбоцитарный фактор роста PDGF (Platelet-Derived Growth Factor) стимулирует пролиферацию фибробластов, а вырабатываемый CD4+ T-лимфоцитами и макрофагами ТФР-β стимулирует синтез коллагена. Кроме того, факторы роста, вырабатываемые макрофагами, вызывают образование дополнительных кровеносных сосудов – ангиогенез.
Глава 9. ТОРМОЖЕНИЕ ИММУННОЙ СИСТЕМЫ
Для нормальной жизнедеятельности организма процессы торможения в иммунной системе так же необходимы, как и процессы её активации. Поясним на нескольких примерах: после уничтожения и выведения патогена из организма иммунный ответ естественным образом останавливается – развивается супрессия иммунного ответа, а иммунный ответ на собственные ткани организма предотвращает иммунная толерантность. Наконец, чрезвычайно важно торможение иммунной системы и при таких антропогенных вмешательствах, как трансплантация органов и тканей. Ключевые роли в торможении иммунной системы принадлежат двум механизмам: ингибирующим межклеточным взаимодействиям и апоптозу.
АПОПТОЗ
Апоптоз (от греч. apoptosis – листопад) – программированная (регулируемая) гибель клеток путём деградации её компонентов, включая конденсацию хроматина и фрагментацию ДНК, с последующим фагоцитозом макрофагами. Необходимые для апоптоза гены («программа смерти») есть в каждой клетке, но их транскрипция начинается только при получении клеткой сигнала к апоптозу.
• Апоптоз в иммунной системе
– В иммунной системе апоптоз развивается при удалении аутореактивных клонов иммунокомпетентных клеток, регуляции численности пролиферирующих клеточных популяций, повреждении генома клеток.
– Аномально повышенная устойчивость (резистентность) клеток к апоптозу играет важную роль в патогенезе аутоиммунных нарушений и злокачественных новообразований за счёт подавления процесса гибели дефектных и мутантных клеток: например, при аутоиммунном лимфопролиферативном синдроме угнетён
апоптоз лимфоцитов, что вызвано мутацией гена, кодирующего «рецептор смерти» – гликопротеин Fas.
– Аномально повышенная гибель клеток путём апоптоза сопровождает острые (инфекционные заболевания, ишемические повреждения), а также ряд хронических патологий (нейродегенеративные заболевания, синдром приобретённого иммунодефицита).
– В иммунной системе известны рецепторы, связывание которых с лигандами индуцирует апоптоз в клетке-носителе рецептора.
◊ Рецепторы DR (от Death Receptor), относящиеся к семейству рецепторов фактора некроза опухоли (TNFR). Известно 5 разновидностей молекул группы DR. Их лигандами являются мембранные или растворимые молекулы семейства фактора некроза опухоли:
– Fas (CD95, DR1), лиганд которого – FasL – экспрессирован на ДК тимуса и индуцирует апоптоз тимоцитов при негативной селекции. Тот же лиганд присутствует на мембране ЦТЛ и естественных киллеров и вызывает гибель клеток-мишеней;
– TNFRI (TNF Receptor-1, CD120a, DR2) – рецептор типа 1 для фактора некроза опухоли;
– DR3-DR6. Их лигандами являются: TRAIL (TNF-Related Apoptosis-Inducing Ligand) – для DR4 и DR5, TL1A и Tweak (TNF-related weak inducer of apoptosis) – для DR3 и N-APP –
для DR6.
◊ CD30 на тимоцитах или T-лимфоцитах. Эта молекула тоже участвует в негативной селекции, связываясь с лигандом CD30L на эпителии и ДК мозговой зоны тимуса.
◊ Ядерный рецептор для глюкокортикоидов, индуцирующих апоптоз тимоцитов при позитивной селекции в тимусе и, вероятно, апоптоз активированных лимфоцитов в периферических тканях.
• Факторы транскрипции, образующиеся при активации лимфоцитов, – АP-1, NFAT – способствуют экспрессии рецепторов, индуцирующих апоптоз, что приводит к гибели лимфоцитов после выполнения ими своих функций. Этот феномен получил название «индуцированной активацией смерти клеток» (AICD – ActivationInduced Cell Death).
• Гены, продукты которых предотвращают апоптоз: Bcl-2, Bcl-xL, Bcl-w, Mcl-1, ALG-3 и др. Транскрипция этих генов происходит при получении клеткой «сигнала на выживание». Для B-лимфоцитов таким сигналом служит связывание BCR с антигеном, для тимоцитов – удовлетворительное связывание TCR с MHC при позитивной селекции, для периферических T-лимфоцитов – постоянное узнавание эндогенных пептидов в комплексе с MHC.
• Макрофаги и ДК сорбируют и поглощают апоптозные тельца с помощью интегринов, молекул CD36 и рецепторов-«мусорщиков», а затем разрушают их содержимое до мелких метаболитов. При этом ДК способны экспрессировать на мембране комплексы этих метаболитов с молекулами MHC-I и MHC-II – это лежит в основе развития иммунного ответа на собственные повреждённые ткани и тканевые антигены чужеродных трансплантатов.
В зависимости от механизмов запуска выделяют митохондриальный (эндогенный) и рецепторный (экзогенный) апоптоз. Развитие или защита от апоптоза определяется балансом про- и противоапоптотических факторов семейства Вcl-2 в мембранах митохондрий (рис. 9-1). Вcl-2 и Bcl-xL являются противоапоптотическими факторами, постоянно связанными с мембранами митохондрий, а Bax, Bim, Bik, Bak и т.д. – проапоптотическими факторами, способными циркулировать в цитоплазме. Включение программы митохондриального апоптоза индуцируется определёнными сигналами из цитоскелета, в результате чего противоапоптотические факторы релокализуются, димеризуясь с молекулой Bcl-2 в митохондриальной мембране и нейтрализуют её антиапоптотический потенциал. Проапоптотические факторы формируют димеры, образующие пору в митохондриальной мембране, через которую из митохондрии в цитозоль поступает цитохром С. Apaf-1 (Apoptotic peptidase activating factor 1) связывает цитохром С, и к этому комплексу подсоединяется димер прокаспазы 9. Формирующаяся надмолекулярная структура называется апоптосомой. В составе апоптосомы прокаспаза 9 превращается в активную каспазу 9 путём аутокаталитического отщепления N-концевого участка.
Каспазы – это сериновые протеазы, разрывающие полипептидную связь после остатка Asp (отсюда их название). Выделяют инициаторные и эффекторные каспазы. Каспаза 9 относится к инициаторным каспазам. Она, как и другие инициаторные каспазы, отщепляет фрагменты эффекторных каспаз (чаще всего каспазы 3), переводя их в активную форму. Митохондриальная форма апоптоза играет основную роль в
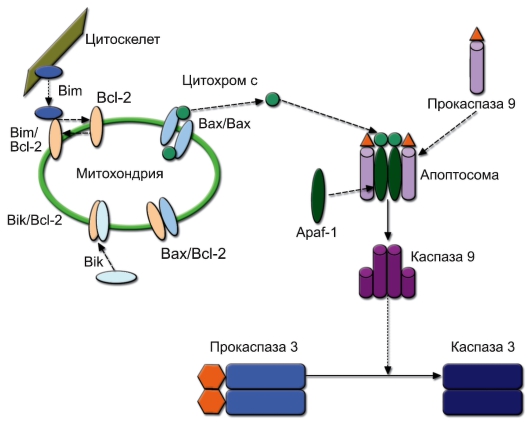
Рис. 9-1. Митохондриальный механизм запуска апоптоза. Пояснения см. в тексте
процессах морфогенеза, в том числе при положительной селекции Т-лимфоцитов.
Запуск апоптоза под влиянием внешних факторов (рецепторный апоптоз) обеспечивают рецепторы DR (от Death Receptor) – рис. 9-2. Следует отметить, что все рецепторы DR за исключением Fas могут также вызывать активацию NF-kB (индукция пролиферации и выживания). Рецепторы DR в цитоплазматической части содержат домен смерти DD (Death Domain), активация которого и запуск апоптотического сигнала происходят при тримеризации рецептора, вызываемой связыванием лигандов. Тримеризация рецепторов и их внутриклеточных DD придаёт последним способность образовывать так называемый «сигнальный комплекс». В случае рецепторов Fas и TRAIL это DISC (Death Initiating Signaling Complex), образуемый при взаимодействии с гомологичным DD доменом цитоплазматического адаптерного белка FADD (Fas-Associated
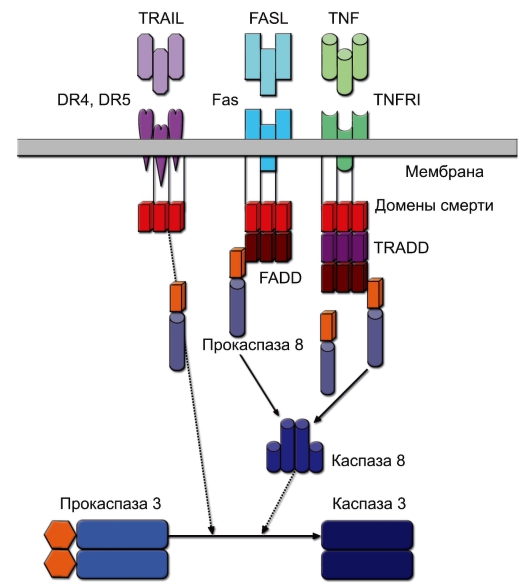
Рис. 9-2. Рецепторный механизм запуска апоптоза. Пояснения см. в тексте
Death Domain protein). В случае рецептора TNFRI, чтобы сформировать сигнальный комплекс 1 и обеспечить связывание с белком FADD, необходимо вначале рекрутировать белок TRADD (TNF-Related Death Domain protein). FADD кроме DD домена также содержит эффекторный DED-домен (Death Effector Domain), который приобретает сродство к гомологичному участку некоторых инициаторных прокаспаз, в типичном случае – прокаспазы 8 (а также каспазы 10). Связывание этих молекул приводит к аутокаталитическому отщеплению от каспазы 8 гомолога DED и формированию активной каспазы 8, способной активировать каспазу 3 и другие эффекторные каспазы. В некоторых клетках каспа-
за 8 может также запускать митохондриальный путь апоптоза через активацию фактора Bid.
Каспаза 3 и другие эффекторные каспазы имеют многочисленные молекулы-мишени, локализующиеся в ядре и цитоплазме. Расщепление этих мишеней определяет многообразные изменения морфологии и функции клетки, которые проявляются в процессе апоптоза. Основной мишенью эффекторных каспаз является Са2+Mg2+-зависимая эндонуклеаза – CAD (от Caspase-Activated DNAse). Этот фермент обусловливает разрывы ДНК между нуклеосомами. Конечным результатом многообразных изменений в клетке является её гибель, как полагают, наступающая в результате истощения энергетических ресурсов, которые тратятся на неэффективную репарацию разрывов ДНК. Гибель по механизму апоптоза проявляется в сморщивании клетки, конденсации хроматина, образовании отростков клеточной мембраны и, наконец, фрагментации ядра и всей клетки с образованием апоптотических телец.
Рецепторная форма апоптоза свойственна зрелым лимфоцитам при их взаимодействии с лигандами апоптоза, локализующимися на активированных клетках, а также с антигеном, цитокинами и т.д. Рецепторный апоптоз реализуется при отрицательной селекции тимоцитов и незрелых В-клеток.
СУПРЕССИЯ ИММУННОГО ОТВЕТА
Супрессия иммунного ответа в норме развивается по мере элиминации антигенов из организма. Элиминация антигенов означает устранение исходного причинного фактора активации лимфоцитов через TCR и BCR, в результате новые (наивные) лимфоциты становится «нечем» активировать.
Супрессия лимфоцитов
• Терминально дифференцированные лимфоциты имеют ограниченное время жизни и погибают по механизму апоптоза, «отработав» свою программу. В таких лимфоцитах снижается экспрессия генов, защищающих лимфоцит от апоптоза на время иммуногенеза, но экспрессируются индуцирующие апоптоз рецепторы, а именно: молекула Fas (CD95), рецепторы для глюкокортикоидов и ФНОα. Следовательно, глюкокортикоидные гормоны, ФНОα и FasL в определённое время от начала развития иммунного ответа становятся факторами физиологической иммуносупрессии.
• Механизмы торможения. Известно несколько конкретных механизмов торможения активности лимфоцитов.
– T-лимфоциты-регуляторы. В первую очередь это активность регуляторных T-лимфоцитов (Treg), продуцирующих значительные количества иммуносупрессорных цитокинов – ИЛ-10 и ТФРβ.
– Th1-лимфоциты подавляют активированные B-лимфоциты той же специфичности через взаимодействие FasL-Fas.
– ИЛ-4 и ИЛ-13, продуцируемые тучными клетками, CD4–/ CD8– T-лимфоцитами, а также дифференцированными Th2клетками, подавляют дифференцировку Th1 из Th0.
– ИФНγ – продукт дифференцированных Th1-лимфоцитов – угнетает дифференцировку Th2 из Th0.
– IgG-антитела, при достижении определённых концентраций в жидких средах организма через специальный ингибирующий рецептор FcγRIIB, экспрессированный на дифференцированных B-лимфоцитах, подавляют биосинтез иммуноглобулинов в данном лимфоците и его дифференцировку в плазматическую клетку. В клинической практике это явление используют для профилактики резус-конфликта: если резус-отрицательной женщине ввести антирезус-антитела до того, как эритроциты плода успеют попасть в кровь матери, иммунный ответ матери на резус-антиген будет подавлен.
• «Аутокиллеры». В организме образуются особые T-лимфоцитыкиллеры с признаками NK-клеток, на которых экспрессировано много Fas-лиганда. Связывая Fas на активированных T-лимфоцитах, эти «аутокиллеры» индуцируют апоптоз активированных T-лимфоцитов.
– Таких «аутокиллеров» много в печени. Вероятно, их природная роль – ликвидировать приносимые с кровью воротной вены лимфоциты, активированные в тканях кишечника пищевыми антигенами.
– Печень как иммуносупрессорный орган. В печени локализовано большинство всех естественных киллеров организма, причём преобладает одна из двух больших субпопуляций NK-клеток, а именно CD56high CD16–, тогда как в крови и красной пульпе селезёнки преобладают естественные киллеры с фенотипом CD56low CD16+.
– На NK-клетках печени экспрессировано много Fas-лиганда, а на клетках эндотелия синусоидов печени – особого лектина, на-
зываемого галектин-1, который, возможно, тоже служит индуктором апоптоза активированных лимфоцитов. Не исключено, что это объясняет неотторжение чужеродных трансплантатов печени.
• Ингибирующие рецепторы. Известно не менее 22 мембранных молекул, функционирующих как негативные корецепторы, т.е. способных подавлять активацию клетки, вызванную через другие рецепторы. Ингибирующие рецепторы объединили в семейство молекул SIRP (Signal-Regulatory Proteins) суперсемейства иммуноглобулинов. Рецепторы семейства SIRP в цитоплазматической части содержат от 1 до 4 тирозинсодержащих аминокислотных ингибирующих последовательностей ITIM (Immunoreceptor Tyrosinebased Inhibitory Motif). Эти негативные корецепторы связаны со всеми рецепторами факторов роста, а также обнаружены при рецепторах гормонов (например, инсулина), взаимодействующих внутри клетки с тирозинкиназами.
– PIR-B (Paired Immunoglobulin-like Receptor – парные иммуноглобулиноподобные рецепторы B-лимфоцитов) на B-лимфоцитах мыши, PD-1 (Programmed cell Death – запрограммированная смерть клетки, CD279) и CTLA-4 (Cytotoxic T-lymphocyte Associated protein – белок, ассоциированный с ЦТЛ, CD152) на T-лимфоцитах связаны с ингибиторными фосфатазами SHP-1 и SHP-2, блокирующими активацию киназ семейства Tec и фосфолипазы PLCγ
– KIR (Killer cell Immunoglobulin-like Receptor – иммуноглобулиноподобные рецепторы клеток-киллеров). Рецепторы семейства KIR на ЦТЛ и NK-клетках человека распознают молекулы MHC-I и подавляют тот или иной тип цитотоксичности.
– FcγRIIB-1/2 на B-лимфоцитах и лейкоцитах миелоидного ряда распознают комплексы IgG с антигеном и подавляют образование антител и активацию лейкоцитов.
– На B-лимфоцитах есть ещё один ингибирующий рецептор – CD22. Это димерная молекула семейства лектинов, экспрессируемая только зрелыми B-лимфоцитами.
В табл. 9-1 приведена краткая характеристика некоторых ингибирующих рецепторов.
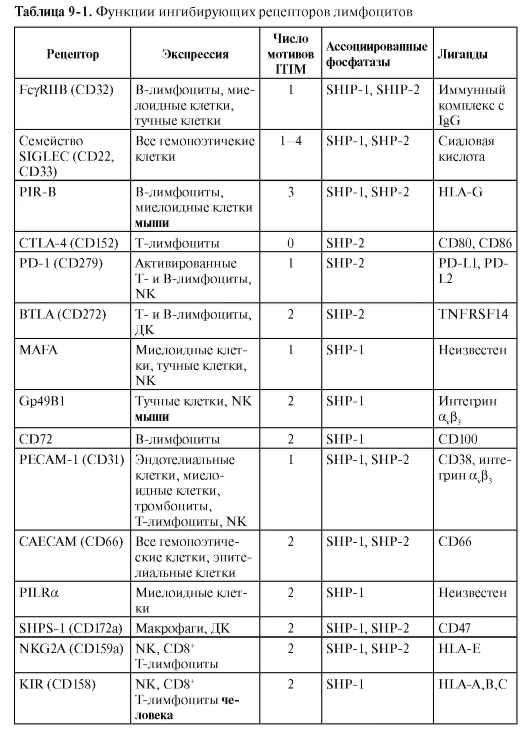
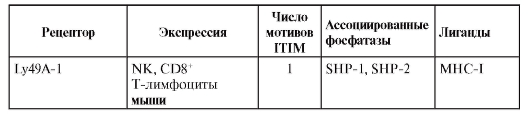
Супрессия лейкоцитов
Супрессия лейкоцитов достигается теми же двумя путями, что и в случае лимфоцитов: апоптозом и подавлением их активности при помощи сигналов через определённые рецепторы.
• Самые короткоживущие лейкоциты – нейтрофилы. Они погибают физиологическим апоптозом через 4-12 ч после выхода из костного мозга в циркуляцию. В очагах воспаления в тканях нейтрофилы погибают ещё быстрее.
• Эозинофилы и базофилы погибают вскоре после дегрануляции.
• Другие клетки, особенно тканевые макрофаги, живут несколько дольше. Именно поэтому для них (по крайней мере, макрофагов и тучных клеток) существуют биологические механизмы подавления активности. Однако после активного проявления деструктивной функции такие клетки тоже погибают и заменяются новыми, мигрировавшими из кровотока: в случае макрофагов – это моноциты, в случае тучных клеток – предшественники тучных клеток.
Известно несколько факторов и механизмов подавления активности лейкоцитов.
• ИЛ-10, продуцируемый дифференцированными естественными регуляторными Т-лимфоцитами, подавляет активность макрофагов.
• ИЛ-4/STAT6 индуцирует в макрофагах биосинтез антагониста рецептора для ИЛ-1.
• Ингибирующие рецепторы. На тучных клетках выявлено, по крайней мере, 3 ингибирующих рецептора. Один из них у мышей – gp49B1, лигандом которого служит интегрин Второй – уже известный по B-лимфоцитам FcyRIIB, связывающий иммунные комплексы антиген-IgG. Третий – MAFA (Mast cell-Associated Function Antigen) впервые идентифицирован на тучных клетках крысы. Лиганд для MAFA неизвестен, но этот рецептор конститутивно ассоциирован в мембране клетки с FcεRI – высокоаффинным активирующим рецептором для IgE.
ИММУННАЯ ТОЛЕРАНТНОСТЬ
Иммунная толерантность – отсутствие активации лимфоцитов (и, следовательно, выработки ими эффекторных молекул) при наличии доступного специфичного антигена. В природе толерантность лимфоцитов как отсутствие ответа на доступный антиген нужна только по отношению к антигенам собственных неповреждённых тканей организма.
• Следует отличать иммунную толерантность от супрессии уже состоявшегося иммунного ответа:
– супрессия – продуктивная активация клона начинается, реализуется, затем подавляется;
– толерантность – продуктивной активации антигенспецифичного клона лимфоцитов не происходит.
Механизмы супрессии и толерантности одинаковы – апоптоз и подавление внутриклеточного метаболизма сигналами с ингибирующих рецепторов, однако эти механизмы реализуются на разных этапах лимфопоэза и иммуногенеза лимфоцитов.
• Делеция клона. Делеция аутореактивных клонов на стадии лимфогенеза приводит к установлению центральной толерантности. По механизму делеции клона, т.е. путём апоптоза лимфоцитов, связавших антиген, происходит элиминация аутореактивных B-лимфоцитов в костном мозге и негативная селекция тимоцитов в тимусе.
• Анергия клона. Анергией клона называют отсутствие полной активации лимфоцитов, распознавших антиген, но не получивших при этом полноценных костимуляторных сигналов. Это один из основных механизмов развития периферической толерантности лимфоцитов после их выхода из центральных органов иммунной системы в периферические для прохождения иммуногенеза. Анергия, вероятно, имеет несколько разных механизмов реализации.
Продуктивная активация аутореактивного лимфоцита может развиться, если он распознаёт комплексы собственных пептидов со «своими» MHC и получает дополнительный сигнал от корецепторов при взаимодействии с активированной АПК. Сверхпороговый уровень экспрессии костимулирующих молекул достигается только при внешней стимуляции АПК, наиболее очевидный фактор которой – воспаление покровных тканей, повреждённых внедрившимся внешним патогеном (в естественных условиях – инфекционным). Таким образом, если организм не травмирован и инфекция не индуцировала развитие вос-
паления, иммунная толерантность лимфоцитов к собственным антигенам – единственно возможное их состояние.
Трансплантация
Трансплантацией называют пересадку тканей или органов, изъятых из одного организма (донора), во внутреннюю среду другого организма (реципиента). Если трансплантацию проводят между организмами одного вида, то это аллотрансплантация, а антигены трансплантата – аллоантигены, реакция иммунной системы – ответ на аллоантигены. Если же трансплантацию проводят между организмами разных видов, то это ксенотрансплантация.
ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА
Трансплантация может быть успешной только при развитии иммунной толерантности организма-реципиента к антигенам трансплантата (на практике это достигается путём медикаментозной иммуносупрессии со всеми её побочными эффектами), в противном случае на тех или иных сроках после операции происходит отторжение пересаженных тканей.
• Сверхострое отторжение происходит во время или вскоре после операции. При этом развивается окклюзия кровеносных сосудов, связывающих трансплантат с организмом реципиента. Это происходит, если реципиент уже был иммунизирован антигенами донора (или антигенами, перекрёстно реагирующими с антигенами донора) и в крови реципиента есть достаточное количество антител к антигенам стенок сосудов или клеток крови донора. Эти антитела немедленно связываются со стенкой сосудов трансплантата, активируют комплемент и систему коагуляции крови, что приводит к быстрому тромбозу сосудов и выключению органа из кровотока.
• Острое отторжение – нормальный первичный иммунный ответ на трансплантат при отсутствии медикаментозной иммуносупрессии. В разрушение трансплантата могут быть вовлечены все известные эффекторные механизмы иммунного ответа – антителозависимые (антителозависимая клеточная цитотоксичность, активация комплемента иммунными комплексами и др.) и антителонезависимые (CD8+ ЦТЛ; Th1-клетки, активируют макрофаги, индуцируя ГЗТ; Тh2-клетки активируют эозинофилы посредством продуцируемого ими ИЛ-5).
• Отсроченное отторжение по эффекторным механизмам аналогично острому, однако в результате эффективной иммуносупрессии индукция иммунного ответа откладывается на несколько лет.
В отторжении аллогенного траснплантата участвуют практически все механизмы адаптивного иммунитета (рис. 9-3). Основными эффектора-
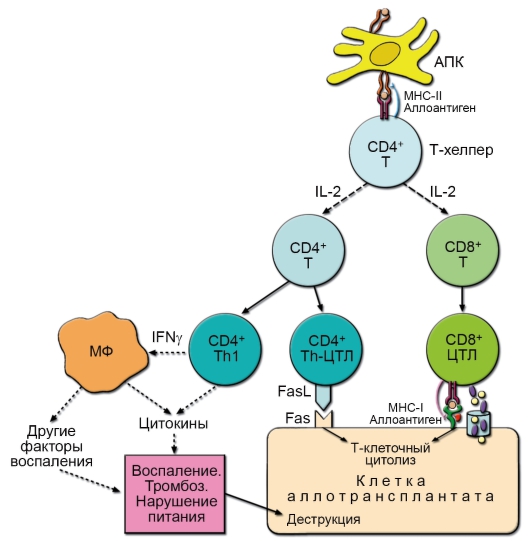
Рис. 9-3. Клеточные факторы и механизмы отторжения трансплантата. ThЦТЛ – это CD4+ T-клетки с цитотоксическим фенотипом. Сплошные стрелки обозначают последующую дифференциацию одной клетки в другую. Стрелки с пунктиром – секретируемые цитокины, воздействующие на другие клетки. Мелкая красная структура – β2-микроглобулин. А цилиндрическая структура рядом схематично показывает проникновение перфорина (мелкие фиолетовые овалы) c гранзимами (мелкие жёлтые кружочки)
ми отторжения являются клеточные факторы. CD8+ Т-клетки, которые обычным путём дифференцируются в цитотоксические Т-лимфоциты (ЦТЛ), вызывают гибель клеток трансплантата преимущественно по механизму перфоринзависимого и Fas-индуцированного цитолиза. CD4+ Т-клетки участвуют в отторжении с помощью двух групп механизмов. Одна из них включает индукцию гибели клеток трансплантата по механизму Fas- и ФНО-зависимого апоптоза. Вторая группа объединяет действие различных факторов воспаления, развивающегося в трансплантате вследствие развития Th1-клеток и активации с их участием макрофагов. Причиной гибели при этом в первую очередь является нарушение питания трансплантата, вызванное изменением микроциркуляции и развитием тромбозов, а также прямое действие цитокинов, ферментов и других факторов, выделяемых в очаге воспаления.
Роль антител в отторжении трансплантата заведомо второстепенна. Связываясь с антигенами трансплантата, антитела блокируют их, не давая возможности проявиться клеточным механизмам защиты. Привлечение в качестве эффекторных агентов факторов комплемента при этом невозможно в связи с активностью на аллогенных (как и на сингенных) клетках системы контроля комплемента, немедленно разрушающих связанные факторы комплемента. В то же время иммунные комплексы, образующиеся при соединении антител с мембранными антигенами трансплантата, могут привлечь клеточные эффекторные механизмы, основанные на распознавании Fc-частей молекул антител. В роли эффекторных клеток-киллеров могут выступать FcR+-клетки – NK-клетки и макрофаги. Такие реакции обозначают как антителозависимый клеточный цитолиз.
Трансплантация костного мозга. Особый случай – пересадка костного мозга или органов и тканей, содержащих много профессиональных АПК. На этих клетках присутствуют все костимуляторные молекулы, необходимые и достаточные для продуктивной активации T-лимфоцитов. Именно поэтому при пересадке кроветворных тканей отторжение MHC-совместимого трансплантата может произойти быстрее, чем MHC-несовместимого, поскольку T-лимфоциты реципиента будут эффективнее работать с АПК донорского происхождения (как с «родными» по MHC). Кроме того, лимфоциты донора могут начать атаковать клетки организма реципиента, вызывая реакцию «трансплантат против хозяина».
ИММУНОПРИВИЛЕГИРОВАННЫЕ ТКАНИ
В организме есть анатомические зоны, в которых аккуратно вживлённый трансплантат при определённых условиях не отторгается. Эти зоны называют иммунопривилегированными. У человека такими местами служат мозг, передняя камера глаза, беременная матка и семенники.
Первоначальное предположение о том, что антигены этих тканей не покидают своих мест и недоступны для распознавания T-лимфоцитами, не подтвердилось: антигены тканей из привилегированных мест покидают их, однако действительно не совсем так, как во всех остальных органах. А именно – антигены минуют классический лимфатический дренаж; иммунопривилегированные органы отграничены особыми барьерами, клетки которых продуцируют иммуносупрессорные цитокины (ТФРР) или экспрессируют много Fas-лиганда, убивающего проникающие в них активные лимфоциты.
С клинической точки зрения существенно, что именно ткани из иммунопривилегированных мест чаще прочих становятся объектом аутоиммунного повреждения (например, демиелинизирующие заболевания мозга, включая рассеянный склероз, симпатическая офтальмия).
ИММУННАЯ СИСТЕМА И ГЛЮКОКОРТИКОИДЫ
Не одно десятилетие глюкокортикоиды применяют в качестве противовоспалительных лекарственных средств, причём при патологиях с очевидным вовлечением в патогенез иммунной системы – ревматические, аутоиммунные, аллергические заболевания. Глюкокортикоиды облигатно вовлечены в лимфопоэз и иммуногенез.
Мишени глюкокортикоидов
• Тимус. Источником глюкокортикоидов, воздействующих на лимфоциты, служат не только надпочечниковые железы – глюкокортикоиды синтезируются и эпителиальными клетками тимуса. Другими словами, в тимусе создаётся нужная локальная концентрация глюкокортикоидов, необходимая для индукции апоптоза, – ≈95-99% тимоцитов при позитивной и негативной селекции.
• Лимфоидная периферия. Главный эффект физиологических концентраций системных глюкокортикоидов на лимфоциты в периферических тканях – индукция апоптоза активированных лимфоцитов:
глюкокортикоиды служат исполнителями индуцированной активацией клеточной смерти (AICD). Эффекты глюкокортикоидов. В фармакологических концентрациях глюкокортикоиды вызывают следующие эффекты:
• стимулируют в активированных лимфоцитах и эозинофилах эндонуклеазы, разрушающие ДНК в межнуклеосомных участках, что заканчивается апоптозом клеток;
• ингибируют биосинтез ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-8, ФНОα, GM-CSF, что приводит к ослаблению воспалительных процессов, зависимых от этих цитокинов;
• подавляют NO-синтазу и, следовательно, снижают зависимую от оксида азота альтерацию тканей, в том числе стенки кровеносных сосудов;
• ингибируют фосфолипазу А2 и циклооксигеназу 2-го типа, необходимые для синтеза простагландинов и лейкотриенов. Как следствие, происходит угнетение воспалительных процессов и спазмов гладкой мускулатуры, зависящих от этих липидных медиаторов;
• угнетают экспрессию молекул межклеточной адгезии, что приводит к снижению экстравазации лейкоцитов и миграции их в очаги воспаления.
Побочные эффекты. Наиболее очевидные побочные эффекты применения терапевтических доз глюкокортикоидов состоят в задержке в организме натрия (а следовательно, и воды), увеличении массы тела, проявлении симптомов диабета, потере минеральных веществ из костей, истончении кожи (а следовательно, и ухудшении её барьерных свойств).
СИСТЕМА МАРКЁРНЫХ АНТИГЕНОВ CD
Система маркёрных антигенов или дифференциальных кластеров антигенов – антигенов CD (от Cluster of Differentiation). Составлено по:
• Mendelian Inheritance in Man (OMIM, McKusick VA, Baltimore: Johns Hopkins University); http://www.ncbi.nlm.nih.gov/sites/entrez?db=OMIM. Ниже в скобках указаны шестизначные номера по OMIM.
• Zymed Labs.Inc; http://www.pathologyoutlines.com.
• Ковальчук Л.В. Антигенные маркёры клеток иммунной системы человека. CD (Cluster Differentiation) система. – М.: РГМУ МЗ и СР РФ,
2005. – 82 с.
• Руководство по иммуногистохимической диагностике опухолей. Издание 3-е, дополненное и переработанное, под редакцией С.В. Петрова, Н.Т. Райхлина. – Казань: РИЦ «Титул», 2004. – 456 с.
EC (Enzyme Classification или Enzyme Comission) – классификация ферментов (соотв. русской аббревиатуре КФ) – http://www.expasy.ch/ sprot/enzyme.html. Коды ферментов приведены по номенклатуре ферментов NC-IUBMB (Nomenclature Committee of the International Union of Biochemistry and Molecular Biology – Комитет по номенклатуре Международного союза по биохимии и молекулярной биологии).
OMIM (Online Mendelian Inheritance in Man) – менделевское наследование признака у человека в реальном режиме времени – база данных, ставшая de facto стандартом генов и генных заболеваний (http://www. ncbi.nlm.nih.gov/Omim/; шестизначные цифровые коды OMIM приводятся в скобках).
Обозначения: (+) – экспрессия маркёра, (-) – отсутствие маркёра, (норма): экспрессия/отсутствие маркёра в норме, (патология): экспрессия/отсутствие маркёра при патологии.
CD1
Антиген кортикальных тимоцитов и ДК – кластер, состоящий из двух подсемейств. Одно из них включает молекулы CD1a, CD1b и CD1c, другое – CD1d и CD1e. CD1 относят к суперсемейству иммуно-
глобулинов; является членом семейства MHC-подобных гликопротеинов класса I. CD1 состоит из тяжёлой α-цепи с молекулярной массой 45-65 кДа, нековалентно связанной с β2-микроглобулином. Число иммуноглобулиновых доменов может варьировать от 1 до 8 и контролируется 5 неполиморфными генами (1q22-q23). CD1 рестриктирует ответ T-лимфоцитов на некоторые антигены, важен для развития T-клеток. CD1+ T-клетки распознают как пептидные антигены, так и липидные антигены микобактерий (миколевые кислоты и производные липоарабиноманнана).
• CD1a (OMIM 188370). (+) – (норма): кортикальные тимоциты (70%), активированные T-клетки, клетки Лангерганса, ДК; (+) – (патология): пре-T-клетки острого лимфолейкоза с фенотипом кортикальных тимоцитов, при гистиоцитозе клеток Лангерганса, при миелолейкозе, злокачественные B-клетки, ДК кожных T-лимфом. (-) – зрелые периферические T-лимфоциты.
• CD1b (OMIM 188360). (+) – (норма): те же клетки, что и CD1a. (+) – (патология): миелолейкозы, некоторые злокачественные B-клетки.
• CD1c (OMIM 188340). (+) – (норма): те же клетки, что и CD1a, и CD1b, а также субпопуляция нормальных периферических B-клеток. CD1c+ T-клетки дополнительно распознают микобактериальные гексозил-1-фосфоизопреноиды и маннозил-Р1фосфодолихолы. (+) – (патология): миелолейкозы и некоторые B-клеточные опухоли.
• CD1d (OMIM 188410). (+) – эпителиальные клетки пищеварительного тракта и NKT-лимфоциты, B-лимфоциты и ДК.
• CD1e (OMIM 188411). (+) – ДК.
CD2
LFA-2 (Lymphocyte Function-Associated antigen 2) – антиген 2, ассоциированный с функцией лимфоцитов, рецептор E-розеткообразующих клеток, рецептор для эритроцитов барана (OMIM 186990; 1p13.1). Молекулярная масса 50 кДа. Поверхностный антиген 95% тимоцитов, 99% зрелых периферических T-лимфоцитов, 80-90% NK-клеток, 50% редких тимических B-лимфоцитов. Функции: в качестве молекулы адгезии взаимодействует с лигандом CD58 (LFA-3) АПК, участвует в альтернативной активации T-клеток; регулирует T- и NK-опосредованный цитолиз, ингибирует апоптоз активированных периферических T-лимфоцитов. (+) – тимоциты, T-клетки, NK-лимфоциты.
• CD2R – CD2-эпитоп активированных T-лимфоцитов. (+) – активированные T-клетки.
• CD2AP (CMS) – ассоциированный с CD2 белок AP (OMIM 604241, хромосома 6) – связывается с цитоплазматическим концом CD2. Необходим для передачи внеклеточных сигналов к цитоскелету.
• CD2BP1 (PSTPIP) – связывающий CD2 белок 1 (OMIM 606347; 15q24-q25.1) – участвует в регуляции активности онкогена ABL.
• CD2BP2 – связывающий CD2 белок 2 (OMIM 604470) – необходим для связывания CD2 с CD58.
CD3
Входит в состав αβTCR и γδTCR; принадлежит к суперсемейству иммуноглобулинов; состоит из четырёх полипептидных цепей: димера цепей e (масса каждой цепи 20 кДа), цепей у (25-28 кДа) и 5 (20 кДа). Эти цепи нековалентно связаны между собой, а также с димерами TCR и двумя ζ-цепями рецептора. Контролируется расположенным в локусе 11q23 тесно сцепленным кластером генов. Цитоплазматический хвост цепей CD3 содержит по одному домену ITAM, фосфорилирование которых индуцирует возникновение внутриклеточного активирующего сигнала и передачу его по сигнальному пути к клеточному ядру. Фосфорилирование осуществляется связанными с рецепторным комплексом киназами Fyn и Lck, активирующимися в результате взаимодействия лиганд-TCR. (+) – тимоциты, периферические T-лимфоциты (60- 80%), NKT-клетки, большинство клеток хронического T-клеточного лейкоза, 70% клеток острого T-клеточного лейкоза.
• CD3G (у) (OMIM 186740).
• CD3D (5) (OMIM 186790).
• CD3E (e) (OMIM 186830).
CD4
Мономерный трансмембранный гликопротеин суперсемейства иммуноглобулинов (OMIM 186940; 12pter-p12). Молекулярная масса 55 кДа. Содержит 4 внеклеточных домена (D1-D4), трансмембранный домен и цитоплазматический участок. Служит маркёром T-хелперов. Выполняет функции корецептора αβTCR – связываясь с инвариантным β2-доменом MHC-II, участвует в распознавании молекул процессированного антигена, презентируемого АПК. Через цитоплазматическую часть молекулы и нековалентно связанную с ней тирозинкиназу Lck участвует в трансдукции активирующего внутриклеточного сигнала. Является рецептором для ВИЧ, связываясь через домен D1 с белком ви-
руса gp120. (+) – (норма): тимоциты (80-90%), зрелые T-лимфоциты (65% T-хелперов), моноциты, макрофаги, клетки Лангерганса, ДК. (+) – (патология): некоторые опухоли T-клеточного происхождения.
CD5
Поверхностноклеточный трансмембранный гликопротеин с молекулярной массой 67 кДа (11q13); имеет цитоплазматический домен, участвующий в передаче сигнала. Относится к семейству обогащённых цистеином рецепторов-«мусорщиков» SRCR (Scavenger Receptor CysteineRich; от англ. scavenger – мусорщик), называют также – «скэвенджеррецептор». Участвует в процессах адгезии T- и B-лимфоцитов. Физически связан с антигенраспознающими рецепторами T- и В1-лимфоцитов. При формировании сигнального пути образует физическую связь между ζ-цепью TCR и внутриклеточными протеинтирозинкиназами. Лигандами для CD5 служат gp40-80, CD72, каркасная область молекул иммуноглобулинов. (+) – тимоциты, все зрелые T-лимфоциты, отдельная субпопуляция В1-лимфоцитов (В1а-клетки).
• CD5L (SPa) – подобный CD5 антиген (OMIM 602592; 1q21-q23). SPa относят к рецепторам модифицированных липопротеинов (рецепторам-«мусорщикам»). Играет роль в регуляции апоптоза в макрофагах и моноцитах. (+) – лимфоидные клетки селезёнки, тимуса, клетки костного мозга, печени плода.
CD6
Одноцепочечный трансмембранный гликопротеин (11q13) молекулярной массой 105-130 кДа; имеет 3 внеклеточных домена. Служит молекулой адгезии между тимоцитами и клетками тимического эпителия. Принадлежит к семейству рецепторов-«мусорщиков». (+) – (норма): незрелые (низкий уровень) и зрелые тимоциты, большинство периферических T-клеткок, часть B-лимфоцитов, некоторые нейроны. (+) – (патология): B-клетки хронического лимфолейкоза. Лиганды CD6: CD166 и ALCAM (молекула адгезии активированных лейкоцитов).
CD7
Трансмембранный и секреторный белок (17q25.2-q25.3~). Молекулярная масса 40 кДа. Принадлежит к суперсемейству иммуноглобулинов. Играет важную роль в активации T-лимфоцитов, во взаимодействии между T- и B-лимфоцитами в период раннего развития лимфоцитов. (+) – (норма): тимоциты и лимфоциты периферической крови (85%), большинство NK-клеток. (+) – (патология): маркёр T-клеточного острого лимфолейкоза.
Корецептор αβT-лимфоцитов, маркёр ЦТЛ. Взаимодействует с инвариантным доменом α3 MHC-I при распознавании комплекса пептид- MHC. Принадлежит к суперсемейству иммуноглобулинов; существует в двух формах: гомодимерной c двумя цепями α (молекулярная масса каждой цепи 32 кДа) и гетеродимерной с цепями β (молекулярная масса 37 кДа) и α. Цепи имеют по одному внеклеточному домену, в гомо- и гетеродимерах соединены дисульфидной связью. При помощи цитоплазматической части цепей молекулы и тирозинкиназы Lck, нековалентно связанной с α-цепью, участвует в трансдукции активирующего внутриклеточного сигнала. (+) – тимоциты (90%), 25-35% зрелых периферических T-клеток (цитотоксические лимфоциты), NK-клетки (30%).
• CD8A – полипептидная α-цепь (OMIM 186910; 2p12).
• CD8B – полипептидная β-цепь (OMIM 186730; 2p12).
CD9
Поверхностный трансмембранный антиген (OMIM 143030; 12p13). Существует в двух изоформах: с молекулярной массой 24 кДа и 36 кДа. Принадлежит к семейству тетраспанинов. Участвует в адгезии клеток и в активации тромбоцитов, взаимодействует с интегринами и гликопротеином Psg17 из группы специфичных для беременности белков PSG (Pregnancy-Specific Glycoproteins) семейства раково-эмбриональных антигенов; необходим также для миграции и слияния клеток (например, при оплодотворении и в миогенезе). (+) – активированные T-лимфоциты; ранние, активированные и дифференцированные B-лимфоциты; моноциты, тромбоциты, эозинофилы, базофилы, клетки эндотелия сосудов, а также в нервных структурах, мышцах, париетальном эпителии гломерул, тубулярном эпителии почек и др.
• CD9P1 (PTGFRN, FPRP) – негативный регулятор рецептора простагландина F2 (OMIM 601204; 1p13.1-q21.3) – взаимодействует с CD9 и CD81. (+) – кератиноциты и клетки слюнных желёз, а также во множестве трансформированных клеточных линий (например, HeLa).
CD10
Трансмембранный гликопротеин молекулярной массой 100 кДа (3q25.1-q25.2) (CALLA – от Common Acute Lymphocytic Leukemia Antigen – общий антиген острого лимфобластного лейкоза и его маркёр; мембранная Zn-металлоэндопептидаза [EC 3.4.24.11], нефрилизин [энкефалиназа]; нейтральная эндопептидаза NEP [от Neutral EndoPeptidase]).
Выявление CD10 подтверждает диагноз эндометриоза, лимфомы Беркитта, фолликулярной лимфомы, рака толстой кишки. (+) – (норма): кора надпочечников, пре-B-клетки, головной мозг (в том числе сосудистое сплетение), кортикальные тимоциты, строма эндометрия, клетки центров размножения лимфоидных фолликулов, гранулоциты, печень, плацента, щёточная каёмка энтероцитов. (+) – (патология): аденомиоз эндометрия, пре-B-лимфоцитарный острый лимфолейкоз (75%), бластный криз при хроническом миелолейкозе (90%), карцинома толстой кишки, дерматофиброма и дерматофибросаркома, аденокарцинома эндометрия, опухоли стромы эндометрия, рак желудка, глиомы, гепатоцеллюлярная карцинома, аденокарцинома поджелудочной железы, меланома, опухоли производных мезонефроса, мюллеровых и вольфовых протоков, опухоли почек и простаты, рабдомиосаркома, шваннома, миома и миосаркома матки.
CD11
Группа поверхностноклеточных рецепторов (ITGA, интегрины a), осуществляющих адгезию лейкоцитов между собой и к межклеточному матриксу. ITGA – гетеродимеры, состоящие из нековалентно связанных цепей – лёгкой, идентичной Р-цепи (CD18), и разных тяжёлых a-цепей, обозначаемых как CD11a, CD11b, CD11c и CD11d; их гены локализованы в локусе 16p11.2.
• CD11a (ITGAL) – белок с внеклеточной, трансмембранной и цитоплазматической частями. Молекулярная масса 180 кДа. Принадлежит к семейству β2-интегринов (αLβ2), является субъединицей αL интегрина LFA-1 (LFA1A, OMIM 153370). Он опосредует большинство иммунных, воспалительных и эффекторных реакций, обеспечивает адгезию (в комплексе с CD18; комплекс «CD11a/ CD18») ЦТЛ к их мишеням. (+) – все лейкоциты, включая T- и B-лимфоциты, макрофаги, нейтрофилы, эозинофилы. Лиганды: ICAM-1 (CD54), ICAM-2 (CD102), ICAM-3 (CD50).
• CD11b (ITGAM) – субъединица αM рецептора CR3 для компонента комплемента iC3b (Mac-1, Mo1A, интегрин CR3, рецептор для iC3b, CR3A) (OMIM 120980). Молекулярная масса 165 кДа. Принадлежит к семейству β2-интегринов (αMβ2). Обеспечивает адгезию нейтрофильных лейкоцитов между собой и к поверхности эндотелия, а также фагоцитоз частиц, опсонизированных iC3b. Лиганды: фибриноген, фактор свёртывания X, ICAM-1 (CD54), Saccharomyces cerevisiae, Staphylococcus epidermidis, Histoplasma capsulatum. (+) – (норма): ФДК, моноциты, макрофаги, гранулоциты, некоторые
NK-клетки, некоторые B- и T-лимфоциты; (+) – (патология): клетки острого миелолейкоза: M1-M3 (35-70%), M4-M5 (80- 90%), волосатоклеточный лейкоз (99%).
• CD11c (ITGAX) – белок с внеклеточной, трансмембранной и цитоплазматической частями. Молекулярная масса 150 кДа. Является субъединицей αX рецептора CR4 для компонента комплемента iC3b (интегрин CR4, рецептор для iC3b) (OMIM 151510). Принадлежит к семейству β2-интегринов (αxβ2). CD11c участвует в удалении опсонизированных частиц и иммунных комплексов, связывается с фибриногеном, необходим для адгезии макрофагов и нейтрофилов к эндотелию. Лиганды: iC3b, CD23, ICAM-1 (CD54), фибронектин. (+) – (норма): 50% активированных CD4/CD8+ T-клеток, гранулоциты, моноциты, макрофаги, ДК и NK-клетки. (+) – (патология): клетки острого миелолейкоза – M4-M5 (50%), волосатоклеточный лейкоз (99%), B-лимфоцитарный хронический лимфолейкоз (хороший прогноз).
• CD11d (ITGAD) – субъединица αD семейства β2-интегринов (αDβ2)
(OMIM 602453), связывает CD50.
CDw12
Фосфопротеин молекулярной массой 150-160 кДа. (+) – гранулоциты, моноциты, NK-клетки, тромбоциты.
CD13
GP150. Поверхностный антиген лейкоцитов GP150, аминопептидаза N-PEPN (EC 3.4.11.2; OMIM 151530; 15q25-q26). Рецептор некоторых коронавирусов – возбудителей инфекционных заболеваний верхних дыхательных путей. Дефекты GP150 приводят к развитию лейкозов/ лимфом; аутоантитела к CD13 вовлечены в развитие хронической реакции «трансплантат против хозяина» после трансплантации костного мозга. (+) – ранние предшественники моноцитов и гранулоцитов, эндотелий, фибробласты, остеокласты; микроворсинки энтероцитов, эпителия канальцев почки, плаценты, жёлчных ходов; синаптические мембраны, периневрий; антиген миелоидных клеток (CD33 более специфичен). (+) – (патология): острый миелолейкоз: M1-M5 (75-95%), M6 (обычно); хронический миелолейкоз (90%); острый лимфолейкоз: пре-B-клетки (10%), пре-T-клетки (редко).
CD14
Рецептор для ЛПС, эндотоксинов (OMIM 158120; 5q31). Связывание ЛПС и CD14 через LBP (LPS Binding Protein – ЛПС-связывающий бе-
лок) приводит к активации макрофагов и секреции цитокинов. CD14 существует также в растворимой форме в сыворотке крови, оказывая провоспалительное действие. (+) – макрофаги/моноциты (90%), слабая экспрессия: гранулоциты, клетки Лангерганса, ДК, B-лимфоциты. (+) – (патология): B-лимфоцитарный хронический миелолейкоз (90%), фолликулярная лимфома (80%), диффузная крупноклеточная B-лимфома (40%), острый миелолейкоз: M4/M5 (50-90%).
CD15
Концевой разветвлённый трисахарид, входящий в состав гликолипидов и многих гликопротеинов клеточной поверхности (OMIM 104230; 11q21). Молекулярная масса 46 кДа. (+) – миелоидные клетки (90%), активированные B- и T-клетки (в том числе при инфекционном мононуклеозе), эозинофилы; клетки Рид-Штернберга. (+) – (патология): 20% клеток T-лимфом, 5% клеток B-лимфом.
• CD15s – лиганд CD62P и CD62E. (+) – гранулоциты и макрофаги.
• CD15u – сульфатированный CD15.
CD16
Трансмембранный белок молекулярной массой 50-80 кДа суперсемейства иммуноглобулинов – низкоаффинный рецептор для Fcфрагмента IgG III (FcγRIII) (OMIM 146740; 1q23). Экспрессируется на нейтрофилах, макрофагах, эозинофилах, NK-клетках. Опосредует фагоцитоз, антителозависимую клеточную цитотоксичность.
• CD16a (FcγRIIIA). (+) – NK-клетки (10-20%), гранулоциты, моноциты (редко), альвеолярные макрофаги, некоторые T-лимфоциты. (-) – миелодиспластический синдром.
• CD16b (FcγRIIIB). (+) – нейтрофилы.
CD17
Гликосфинголипид семейства лактозилцерамидов, связывает бактерии. Молекулярная масса 150-160 кДа. (+) – нейтрофилы, макрофаги/ моноциты, тромбоциты, базофилы, B-клетки (CD19+), ДК миндалин.
CD18
Лёгкая β2-цепь семейства интегринов молекулярной массой 95 кДа (21q22.3). Совместно с тяжёлой цепью α формирует: LFA-1 – CD11a/ CD18, CR3 (Mac-1) – CD11b/CD18 и CR4 – CD11c/CD18. (+) – лейкоциты.
Мембранный антиген B-клеток (OMIM 107265; 16p11.2). Молекулярная масса 120 кДа. Принадлежит к суперсемейству иммуноглобулинов. Служит маркёром B-лимфоцитов, входит в состав корецепторного комплекса B-клеток и играет роль адапторной молекулы при внутриклеточной передаче сигнала с BCR; формирует нековалентный комплекс с CD21. (+) – пре-B- и B-клетки.
CD20
Поверхностный антиген B-лимфоцитов (OMIM 112210; 11q12q13.1) – трансмембранный фосфопротеин семейства тетраспанинов. Молекулярная масса 33-37 кДа. (+) – большинство B-клеток (появляется после экспрессии CD10 и CD19, но до экспрессии CD21/CD22 и поверхностных иммуноглобулинов), моноциты/макрофаги, активированные T- и B-лимфоциты, ДК лимфоидных фолликулов. (+) – (патология): 90% клеток B-лимфом, 40% клеток пре-B-лимфоцитарного острого лимфолейкоза, 80% клеток лимфомы Ходжкина.
• CD20L – подобный CD20 антиген (OMIM 606498; 11q12-q13.1) – трансмембранный белок гемопоэтических клеток.
• CD20L2 – подобный CD20 антиген 2 (OMIM 606499; 11q12-q13.1) – трансмембранный белок, экспрессируемый в ткани яичек.
CD21
CR2. Рецептор 2 для компонента комплемента (связывает фрагменты молекул С3 системы комплемента – C3d, iC3b и C3dg, а также антиген gp350/220 вируса Эпштейна-Барр) (OMIM 120650; 1q32). Молекулярная масса 145 кДа. CD21 образует сигнальные комплексы с CD19, CD81, CD225; вместе с CD23 служит маркёром ДК. (+) – зрелые B- и ФДК, тимоциты, клетки эпителия, фетальные астроциты.
CD22
SIGLEC2, BL-CAM. Мембранный антиген B-клеток (OMIM 107266; 19q13.1). Молекулярная масса 140 кДа. Член суперсемейства иммуноглобулинов, сиалоадгезин, молекула адгезии B-клеток, рецептор хоминга B-лимфоцитов в костный мозг. Связываясь с лигандом CD75, обеспечивает взаимодействие между B-лимфоцитами. Нековалентно сцеплен с B-клеточным рецептором. Негативно регулирует силу сигнального пути, индуцируемого взаимодействием лиганд-BCR; служит ингибирующим рецептором B-лимфоцитов. Cвязывается с сиаловой кислотой и FcγRIIB1, взаимодействует с CD45R0 на T-клетках, с IgM и гаптоглоби-
ном в сыворотке. (+) – B-клетки. (+) – (патология): B-лимфоцитарный острый лимфолейкоз.
CD23
FCER2. Низкоаффинный рецептор для IgE, FceRII (OMIM 151445; 19p13.3). Молекулярная масса 45 кДа. Принадлежит к семейству Са2+зависимых лектинов типа С. Индуцирует секрецию клетками провоспалительных цитокинов: ИЛ-1 и ИЛ-6, ФНО, GM-CSF. Взаимодействуя с CD21, опосредует ряд биологически значимых процессов: пролиферацию миелоидных предшественников, межклеточную адгезию, регуляцию синтеза IgE, секрецию гистамина базофилами, рост B-клеток и их выживаемость в зародышевых центрах, созревание протимоцитов и др. (+) – зрелые B-клетки, экспрессирующие IgM или IgD; моноциты/ макрофаги, NK-клетки и некоторые T-лимфоциты, тромбоциты, эозинофилы, базофилы, клетки Лангерганса, ФДК. (+) – (патология): B-лимфоцитарный хронический лимфолейкоз.
CD24
Термостабильный гликопротеин муцинового типа HSA (Heat Stable Antigen) (6q21). Молекулярная масса 35-45 кДа. Принадлежит к семейству заякоренных белков GPI (CD24/HAS/CD52). Способствует дифференцировке и активации гранулоцитов и B-лимфоцитов, соединяясь с P-селектином (CD62P); участвует в процессах костимуляции и адгезии лейкоцитов. (+) – B-лимфоциты на всех стадиях развития до плазматических клеток, миелоидные клетки, зрелые гранулоциты, а также клетки эпителия почек. (+) – (патология): клетки карциномы, большинство пре-B-лимфоцитарных хронических лимфолейкозов, B-лимфомы.
CD25
Низкоаффинная a-цепь рецептора ИЛ-2 (OMIM 606367; 10p15-p14). Молекулярная масса 55 кДа. Вместе с β- (CD122) и γ-цепями (CD132) образует высокоаффинный рецептор для ИЛ-2. Маркёр регуляторных T-клеток, активации T-лимфоцитов; играет важную роль в опосредованном T-клетками иммунном ответе. В мономерной растворимой форме выявляют в сыворотке. (+) – активированные B- и T-клетки, моноциты/макрофаги. (+) – (патология): волосатоклеточный лейкоз.
CD26
DPP4. Дипептидилпептидаза IV (EC 3.4.14.5; OMIM 102720; 2q24.3) – антиген активации Т-клеток, кофактор CD4 (способствует входу ВИЧ в клетки). (+) – зрелые тимоциты, активированные T- и B-лимфоциты,
NK-клетки, моноциты, макрофаги, эпителий канальцев почки, энтероциты, эндотелий синусоидов селезёнки.
CD27
S152. Антиген активации Т-клеток. TNFRSF7. (OMIM 186711;
12p13). Молекулярная масса 110-120 кДа. Трансмембранный гликопротеин суперсемейства рецептора фактора некроза опухоли. Маркёр активации T-клеток. Взаимодействие с CD70 необходимо для пролиферации и дифференцировки B-лимфоцитов в плазматические клетки. (+) -T-клетки, B-клетки памяти.
CD28
Антиген T-клеток (OMIM 186760; 2q33). Молекулярная масса 90 кДа. Член суперсемейства иммуноглобулинов, ключевая костимулирующая молекула для активации и пролиферации T-клеток; рецептор для CD80 (B7-1) и CD86 (B7-2). (+) – CD4+ T-клетки (95%), CD8+ T-клетки (50%), активированные B-клетки, плазматические клетки.
CD29
VLAB, ITGB1, GPIIa. Рецептор для фибронектина, субъединица β1интегрина очень позднего активационного антигена VLA (Very Late Activation antigen) (OMIM 135630; 10р11.2). Молекулярная масса 130 кДа. (+) – фибробласты, тромбоциты, T-клетки.
CD30
TNFRSF8. Антиген (гликопротеин) активации лимфоцитов из суперсемейства рецептора ФНО (OMIM 153243; 1р36). Молекулярная масса 120 кДа. Лиганды: CD30L (CD153) и факторы, ассоциированные с рецептором ФНО – TRAF1, TRAF2, TRAF3, TRAF5 (от TNF Receptor-Associated Factors). (+) – (норма): гранулоциты, плазматические клетки, активированные B- и T-клетки, NK-клетки, моноциты. (+) – (патология): клетки, инфицированные ВИЧ, вирусами HTLV-1, Эпштейна-Барр, HHV8, гепатита B; клетки Рид-Штернберга, 90% анапластических крупноклеточных лимфом, периферические T-клеточные лимфомы, эмбриональные карциномы яичка.
CD31
PECAM-1. Одноцепочечная трансмембранная молекула межклеточной адгезии тромбоцитов и эндотелия типа 1 (OMIM 173445; 17q23). Молекулярная масса 130 кДа. Интегрин αvβ3, член суперсемейства иммуноглобулинов, маркёр эндотелия. (+) – (норма): эндотелий, тромбоциты, макрофаги и клетки Купфера, гранулоциты, NKT-клетки,
мегакариоциты, фибробласты, остеокласты, нейтрофильные лейкоциты. (+) – (патология): эпителиоидная гемангиоэндотелиома, эпителиоидная саркомоподобная гемангиоэндотелиома, плазмоцитомы, некоторые карциномы и саркомы.
CD32
FCGR2A, IGFR2. Низкоаффинный рецептор FcγRIIB для IgG (OMIM 146790; 1q23). Молекулярная масса 40 кДа. Принадлежит суперсемейству иммуноглобулинов. (+) – моноциты, гранулоциты, эозинофилы, B-клетки, базофилы, тромбоциты.
CD33
SIGLEC3. Антиген (гликопротеин) миелоидной дифференцировки (OMIM 159590; 19q13.1). Молекулярная масса 150 кДа. Член семейства сиалоадгезинов. (+) – (норма): миелоидные предшественники, большинство моноцитов, эпидермальные клетки Лангерганса. (+) – (патология): острый миелолейкоз M1-M5 (75-85%), M7, хронический миелолейкоз (90%); бласты (все), некоторые острые лимфолейкозы.
• CD33L1. SIGLEC6. Антиген CD33-подобный, лектин 6, иммуноглобулиноподобный, связывающий сиаловую кислоту
(OMIM 604405).
• CD33L2. SIGLEC5. Антиген CD33-подобный, лектин 5, иммуноглобулиноподобный, связывающий сиаловую кислоту.
CD34
HPCA1. Поверхностный антиген предшественников гемопоэза (OMIM 142230; 1q32). Молекулярная масса 116 кДа. Обладает адгезивными свойствами. CD34 – сильно гликозилированный белок семейства сиаломуцинов; основной маркёр гемопоэтических стволовых клеток человека. (+) – (норма): предшественники гемопоэтических клеток, эндотелий (TdT+, HLADR+). (+) – (патология): альвеолярная саркома, пре-B-лимфоцитарный острый лимфолейкоз (75%), острый миелолейкоз (40%), острый миелолейкоз – M7 (большинство), хордоидные глиомы, дендритная фибромиксолипома, эпителиоидные саркомы, стромальные опухоли пищеварительного тракта, гигантоклеточная фибробластома, гранулоцитарная саркома, гамартомные опухоли при эпилепсии, гемангиоперицитомы (50%), воспалительные фиброзные полипы желудка, саркома Капоши, липосаркомы, злокачественные опухоли нервов, менингеальные гемангиоперицитомы, менингиомы, метанефрическая аденосаркома почки, сосочковая карцинома щито-
видной железы, паратестикулярная лейомиосаркома (30%), шванномы, склерозирующая липосаркома, солитарные фиброзные опухоли, синовиальная саркома, бласты при миелопролиферативных заболеваниях.
CD35
CR1. Рецептор 1 для компонентов комплемента (C3b, C4b, iC3b) (OMIM 120620; 1q32). Молекулярная масса гетерогенна – 35-250 кДа. Связан с эритроцитарными групповыми антигенами Knops, McCoy, Swain-Langley, York. (+) – гранулоциты, макрофаги, B-клетки, T-клетки (10%), часть NK-клеток, эритроциты, ФДК, эозинофилы, подоциты, некоторые астроциты.
CD36
GPIV, GP4, GPIIIb – гликопротеин IV тромбоцитов, рецептор для тромбоспондина семейства рецепторов-«мусорщиков» (OMIM 173510; 7q11.2). Молекулярная масса 90 кДа. Локус фиксации инфицированных Plasmodium falciparum эритроцитов к эндотелию. (+) – (норма): тромбоциты, моноциты, макрофаги, эндотелий мелких сосудов, ранние эритроидные клетки, мегакариоциты. (+) – (патология): острый миелолейкоз M3-M7.
• CD36L1 (SCARB1, CLA1) – антиген CD36-подобный, рецептор типа скэвенджер (OMIM 601040).
• CD36L2 (SCARB2) – антиген CD36-подобный, рецептор типа скэ-
венджер (OMIM 602257).
CD37
Поверхностный антиген лейкоцитов (OMIM 151523; 19p13-p13.4). Молекулярная масса 40-52 кДа. Принадлежит к семейству тетраспанинов (Tetraspanin-26). (+) – (норма): B-клетки, нейтрофильные лейкоциты, гранулоциты, моноциты. (+) – (патология): волосатоклеточный лейкоз, B-клеточные лимфомы.
CD38
Одноцепочечный трансмембранный гликопротеин семейства АДФрибозилциклаз (OMIM 107270; 4р15). Молекулярная масса 45 кДа. Участвует в адгезии между лимфоцитами и эндотелием. (+) – (норма): плазматические клетки, лимфоидные предшественники, NK-клетки, Bи T-клетки, моноциты, эритроидные и миелоидные предшественники, тимоциты, бласты, мозг, мышцы, почки, печень, яичники, поджелудочная железа, плацента, яички. (+) – (патология): лимфома, нейробластома.
ENTPD1. Эктонуклеозидтрифосфатдифосфогидролаза 1, апираза 1 (OMIM 601752; 10q24). Молекулярная масса 78 кДа. Участвует в межклеточной адгезии и в различных клеточных функциях – во взаимодействии ДК и T-лимфоцитов при презентации антигена, в модуляции воспалительного и иммунного ответа, служит ингибитором активации тромбоцитов. Экспрессируется на активированных B-лимфоцитах, NK-клетках, макрофагах, клетках Лангерганса, ДК. (+) – (норма): B- и T-лимфоциты, NK-клетки, эндотелий, плацента.
• CD39L1 (ENTPD2) – апираза 2 (OMIM 602012).
• CD39L2 (ENTPD6) – апираза 6 (OMIM 603160).
• CD39L3 (ENTPD3) – апираза 3.
• CD39L4 (ENTPD5) – апираза 5 (OMIM 603162).
CD40
TNFRSF5. Трансмембранный одноцепочечный белок семейства рецептора фактора некроза опухоли (OMIM 109535; 20q12-q13.2). Молекулярная масса 85 кДа. Служит костимулирующей молекулой при активации АПК и B-лимфоцитов. Взаимодействие CD40 на АПК и CD154 на Th1-клетках играет ключевую роль в формировании клеточного иммунного ответа. (+) – (норма): B-клетки, макрофаги, ДК, эндотелий сосудов, эпителий почек, фибробласты, кератиноциты. (+) – (патология): карциномы, большинство B-клеточных лимфом, B-лимфоцитарные острые лимфолейкозы (некоторые).
CD41
GPIIb. Гликопротеин тромбоцитов IIb (α-цепь комплекса IIb/IIIa; 3q29). Связан с актином цитоскелета – рецептор для фибриногена, фактора фон Виллебранда и фибронектина. (+) – (норма): тромбоциты, мегакариоциты. (+) – (патология): острый миелолейкоз – M7, бласты.
CD42
GPIX. Комплекс CD42a-d.
• CD42a, гликопротеин GP Ib.IX молекулярной массой 23 кДа (3q21). Опосредует адгезию тромбоцитов.
• CD42b, гликопротеин GP Ib молекулярной массой 160 кДа (17pterp12). Гетеродимер из цепей a (CD42b) и Р (CD42c) с дисульфидной связью.
• CD42c, гликопротеин GP IBB молекулярной массой 22 кДа (22q11.21-q11.23). Формирует нековалентный комплекс с CD42a и
CD42d.
• CD42d, гликопротеин GP V молекулярной массой 85 кДа (3q29). Участвует в формировании высокоаффинного рецептора для тромбина. Рецептор фактора фон Виллебранда и тромбина. (+) – (норма): тромбоциты и мегакариоциты.
CD43
SPN, LSN, GPL115. Сиалогликопротеин (сиалофорин, лейкосиалин) (16р11.2; OMIM 182160). Молекулярная масса 95-135 кДа. Одноцепочечная трансмембранная молекула с антиадгезивными свойствами. (+) – (норма): большинство T-клеток, активированные B-клетки, NKклетки, гранулоциты, моноциты, мегакариоциты, мозг; (+) – (патология): 80% T-клеточных лимфом, гранулоцитарные саркомы, острый миелолейкоз, большинство острых лимфолейкозов, плазмоцитомы; болезнь тучных клеток (также «+» к триптазе, CD68, CD117).
CD44
HERMES, Pgp1, MDU3 (OMIM 107269; 16р11.2). Молекулярная масса 85-90 кДа. Трансмембранная многофункциональная молекула (гликопротеин) с адгезивными свойствами. (+) – (норма): T- и B-лимфоциты, моноциты, гранулоциты, ДК, эритроциты, фибробласты, клетки эпителия и эндотелия, молочная железа, толстая кишка, желудок, матка. (+) – (патология): 80% колоректальных карцином.
• CD44H – (CD44s) – главный рецептор гиалуроновой кислоты.
• CD44R – (CD44v).
CD45
LCA, PTPRC. Общий антиген лейкоцитов (1q31-q32), принадлежит к семейству протеинтирозинфосфатазных рецепторов (OMIM 151460). Трансмембранная молекула с внеклеточным доменом и цитоплазматическим участком, состоящим из двух тандемных каталитических фосфатных доменов. Лиганды: CD2, CD3, CD4, CD22. (+) – (норма): гемопоэтические клетки и их предшественники; (-) – эритроциты, негемопоэтические клетки, лимфомы, множественная миелома, клетки Рид-Штернберга.
• CD45RO (молекулярная масса 180 кДа). (+) – (норма): T-клетки памяти, активированные T-клетки, некоторые B-клетки, гранулоциты (слабо), макрофаги (слабо), кортикальные тимоциты. (+) – (патология): 75% T-клеточных неходжкинских лимфом, T-клеточный острый лимфолейкоз, 25% острых миелолейкозов.
• CD45RА (молекулярная масса 205-220 кДа) – клетки мозговой части тимуса.
• CD45RB (молекулярная масса 190-220 кДа).
• CD45RC.
CD46
Мембранный кофакторный белок MCP (Membrane Cofactor Protein) (1q32). Молекулярная масса 45-70 кДа. Связывает компоненты комплемента C3b и С4b, что делает их доступными для расщепления протеазой – фактором I. Рецептор для вируса кори (OMIM 120920), для патогенной Neisseria и для Streptococcus pyogenes группы А. (+) – (норма): все клетки крови, кроме эритроцитов; клетки эпителия, эндотелия, фибробласты.
CD47
IAP, MER6. Ассоциированный с интегрином белок (OMIM 601028; 3q13.1-q13.2). Молекулярная масса 45-60 кДа. Рецептор для тромбоспондина; физически и функционально связан с β3-цепью интегрина (CD61). Принадлежит к суперсемейству иммуноглобулинов, содержит IgV-подобный внеклеточный домен, 5 мембранных сегментов и гидрофобный цитоплазматический хвост. (+) – (норма): гемопоэтические клетки, эпителиальные клетки, эндотелий, фибробласты, клетки мезенхимы. (+) – (патология): линии злокачественных клеток.
• CD47R (новое обозначение антигена CDw149) – относят к антигенам Rh-фактора.
CD48
BLAST1, BCM1. Гликопротеин суперсемейства иммуноглобулинов. Молекулярная масса 40-47 кДа (1q21.3-q22). С низкой аффинностью связывается с CD2, с высокой – с CD244. Участвует в активации T-лимфоцитов; в качестве дополнительной молекулы участвует в процессе распознавания антигена γδT-лимфоцитами. (+) – (норма): большинство лейкоцитов, активированные лимфоциты.
CD49
α-Цепь интегринов αβ1(VLA – Very Late Activation antigen – очень поздний активационный антиген), формируемых объединением различных α- (CD49) и β1-цепей (CD29). Все антигены CD49 участвуют в процессах адгезии, взаимодействия клеток с межклеточным матриксом, трансдукции внутриклеточного сигнала.
• CD49а – α1-цепь (5р11) интегрина (VLA-1) – рецептор для ламинина-1 и коллагена. Молекулярная масса 200 кДа. (+) – (норма): активированные B- и T-клетки, моноциты.
• CD49b – α2-цепь интегрина α2β1 (VLA-2) (OMIM 192975; 5q2331) – рецептор для ламинина-1 и коллагена. Молекулярная масса 160 кДа. Участвует в процессах свёртывания крови, ангиогенеза, гистогенеза, органогенеза. (+) – T- и В-лимфоциты, моноциты, макрофаги, гранулоциты, клетки эндотелия.
• CD49с – α3-цепь (димер с молекулярной массой цепей 125 и 30 кДа) интегрина α3β1 (VLA-3) (OMIM 605025; 17q23.3) – рецептор для ламинина-5, коллагена, фибронектина, тромбоспондина. (+) – (норма): негемопоэтические клетки.
• CD49d – α4-цепь интегрина α4β1 (VLA-4) – рецептор для фибронектина, молекул MAdCAM-1 (Mucosal Addressin Cell Adhesion Molecule-1) и VCAM-1 (Vascular Cell Adhesion Molecule) (2q31-q32). Молекулярная масса 145 кДа. (+) – (норма): моноциты, макрофаги, T- и B-клетки, тимоциты, эозинофилы, базофилы, тучные клетки, NK-клетки, ДК, миелоидные клетки, предшественники эритроцитов. (+) – (патология): клетки меланомы.
• CD49e – α5-цепь (димер с молекулярной массой цепей 135 и 25 кДа) (12q11-q13) интегрина α5β1 (VLA-5) – рецептор для фибронектина, интегрина, инвазина. (+) – (норма): тромбоциты, моноциты, нейтрофильные лейкоциты, T-клетки памяти.
• CD49f – α6-цепь (димер с молекулярной массой 125 и 25 кДа) (2q31.1) интегрина α6β1 (VLA-6) – рецептор для ламинина, инвазина, мерозина. (+) – (норма): T-лимфоциты, моноциты, тромбоциты, мегакариоциты, эпителиальные клетки.
CD50
Мембранная молекула межклеточной адгезии ICAM-3 (Intercellular Adhesion Molecule 3), член суперсемейства иммуноглобулинов. Молекулярная масса 110-140 кДа (19р13.3-р13.2). Лиганд – LFA-1 (CD11a/ CD18). (+) – (норма): лейкоциты, эпидермальные клетки Лангерганса, эндотелий.
CD51
ITGAV; VNRA. Интегрин αV (2q31-q32). Молекулярная масса 125 кДа. Вместе с β3-цепью (CD61) образует адгезивный рецептор для витронектина, фибриногена, фактора фон Виллебранда, тромбоспондина. (+) – (норма): тромбоциты, эндотелий, мегакариоциты.
CD52
Короткий пептид (1р36), относящийся к семейству заякоренных белков GPI (CD24/HAS/CD52). (+) – (норма): тимоциты, моноциты/
макрофаги, эозинофилы, эпителиальные клетки мужской половой системы. (+) – (патология): большинство лимфоидных злокачественных клеток.
CD53
Поверхностный антиген лейкоцитов (OMIM 151525; 1р13). Молекулярная масса 32-42 кДа. Относится к семейству тетраспанинов. (+) – (норма): лейкоциты. (-) – тромбоциты, эритроциты, негемопоэтические клетки.
CD54
ICAM-1 – Intercellular Adhesion Molecule-1. Молекула межклеточной адгезии 1 (OMIM 147840; 19р13.3-р13.2). Молекулярная масса 90 кДа. Трансмембранный антиген активированных клеток эндотелия, активированных T- и B-лимфоцитов; рецептор для риновирусов и инфицированных плазмодиями эритроцитов. Принадлежит к суперсемейству иммуноглобулинов. Лиганды: LFA-1 (CD11a/CD18), Mac-1 (CD11b/ CD18), CD43, CD227. (+) – (норма): B- и T-клетки, моноциты, эндотелий, эпителиальные клетки. (+) – (патология): острый лимфолейкоз, кератоакантома, плоскоклеточная карцинома.
CD55
DAF – Decay Acceleration Factor. Фактор, ускоряющий разрушение комплемента (1q32), антиген группы крови Cromer (OMIM 125240), рецептор для CD97, вирусов Коксаки B. Молекулярная масса 55-70 кДа. (+) – (норма): гемопоэтические клетки, эритроциты, внеклеточный матрикс.
CD56
NCAM-1 – Neural Cell Adhesion Molecule-1. Молекула межклеточной адгезии невральная (OMIM 116930; 11q23.1), трансмембранный гликопротеин суперсемейства иммуноглобулинов. (+) – (норма): NK-клетки (80-90%), активированные T-клетки, головной мозг, нейроэндокринные клетки. (+) – (патология): миелома, миелолейкоз, опухоль Вильмса, нейробластома, NKT-клеточные лимфомы, панкреокарцинома, феохромоцитома, мелкоклеточная карцинома лёгких.
CD57
LEU7, HNK-1. Антиген естественных киллеров (OMIM 151290), олигосахарид. (+) – (норма): 60% NK- и T-клеток, 15-20% мононуклеаров периферической крови, нейроэктодермальные производные, мозг, простата, канальцы почки. (+) – (патология): нейроэктодермальные,
мелкоклеточная карцинома лёгких, аденокарцинома простаты, метанефрическая аденома, карциноиды почки, светлоклеточные опухоли почки, некоторые лимфомы.
CD58
LFA-3 (Lymphocyte Function-Associated antigen 3). Антиген 3, ассоциированный с функцией лимфоцитов (OMIM 153420; 1р13). Молекулярная масса 40-70 кДа. Принадлежит к суперсемейству иммуноглобулинов. Лиганд для CD2, экспрессируется многими типами клеток, опосредует адгезию между АПК и T-хелперами, тимоцитами и клетками эпителия тимуса, клетками-киллерами и клетками-мишенями. (+) – (норма): лейкоциты, эритроциты, эндотелий, эпителиальные клетки, фибробласты.
CD59
Протектин (OMIM 107271; 11р13). Молекулярная масса 18-25 кДа. Мембранный гликопротеин, препятствующий вызванному комплементом лизису собственных клеток. (+) – (норма): большинство клеток.
CD60
Антиген семейства гликолипидов.
• CD60a – GD3 – ганглиозид D3.
• CD60b – 9-O-ацетил-GD3.
• CD60c – 7-O-ацетил-GD3.
(+) – (норма): тромбоциты, CD4+ и CD8+ T-клетки, эпителий тимуса, активированные кератиноциты, синовиальные фибробласты, гладкомышечные клетки, астроциты.
CD61
ITGB3, GP3A. β3-Субъединица интегрина, гликопротеин тромбоцитов IIIa, компонент рецептора для фибриногена (OMIM 173470). Участвует в трансдукции внутриклеточного сигнала. (+) – (норма): тромбоциты, мегакариоциты, миелоидные предшественники, эндотелий. (+) – (патология): острые миелолейкозы – M7, острые миелолейкозы – M6 (некоторые), бласты.
CD62
Селектины – молекулы межклеточной адгезии (OMIM 153240). Принадлежат к семейству лектинов типа С.
• CD62P (селектин P, PADGEM) (1q22-q25). Молекулярная масса 120 кДа. (+) – (норма): тромбоциты, мегакариоциты, эпителий, эндотелий.
• CD62L (селектин L, LAM-1, LECAM-1) (1q23-q25). Молекулярная масса 65-95 кДа. (+) – (норма): NK-клетки, наивные B-, T-клетки; тимоциты, мононуклеары костного мозга, моноциты, нейтрофильные лейкоциты, эозинофилы.
• CD62E (селектин E, ELAM-1) (OMIM 131210; 1q22-q25). Молекулярная масса 115 кДа. (+) – (норма): эндотелий (после стимуляции цитокинами).
CD63
ME491, LAMP-3, NKI-C3. Антиген меланомы – гранулофизин (OMIM 155740; 12q12-q13). Молекулярная масса 53 кДа. Член суперсемейства тетраспанинов, маркёр активации базофилов, вместе с CD82 защищает молекулы MHC-II от протеолитических ферментов. (+) – (норма): B-лимфоциты, активированные T-клетки, макрофаги, нейтрофилы, ДК, базофилы, активированные тромбоциты, фибробласты, остеокласты, эндотелий, гладкие мышцы, нервная ткань, синовиальная выстилка. (+) – (патология): меланома.
CD64
FCGR1B. Высокоаффинный рецептор FcγRI для IgG (OMIM 601502; 1q211). Молекулярная масса 72 кДа. Опосредует фагоцитоз, сорбцию антигенов и иммунных комплексов, антителозависимую клеточную цитотоксичность, высвобождение цитокинов и активных форм кислорода. (+) – (норма): макрофаги/моноциты, ДК, ранние миелоидные клетки, активированные гранулоциты. (+) – (патология): острые миелолейко-
зы M0-M2; M3 (обычно), M4, M5.
CD65
VIM2. Церамид-додекасахарид – молекула адгезии. (+) – (норма): миелоидные клетки, моноциты.
• CD65S – сиалилированный CD65. (+) – (норма): гранулоциты, моноциты. (+) – (патология): клетки миелолейкоза.
CD66
Разные гликопротеины (OMIM 109770), относящиеся к раковоэмбриональным антигенам.
• CD66а (CEACAM1, BGP, C-CAM) – предшественник раковоэмбрионального антигена, рецептор для Neisseria gonorrhoeae и N. meningitidis. (+) – (норма): гранулоциты, эпителиальные клетки, простата, жёлчные капилляры. (+) – (патология): карцинома простаты.
• CD66b (ранее назывался CD67) (CEACAM8) – родственная раковоэмбриональному антигену молекула адгезии 8. (+) – (норма): гранулоциты. (+) – (патология): хронический миелолейкоз.
• CD66c (NCA). (+) – (норма): гранулоциты.
• CD66d – (+) – (норма): гранулоциты.
• CD66e (CEA) – раково-эмбриональный антиген. (+) – (норма): жёлчные протоки, толстая кишка плода, эпителиальные клетки, аденокарциномы пищеварительного тракта, гранулоциты, муцин бокаловидных клеток. (+) – (патология): аденокарцинома лёгких и органов пищеварения, карцинома щитовидной железы.
• CD66f – (+) – (норма): синцитиотрофобласт, печень плода.
CD67
Переименован в CD66b.
CD68
Антиген макрофагов – макросиалин (OMIM 153634; 17р13). Молекулярная масса 110 кДа. (+) – (норма): макрофаги/моноциты, базофилы, ДК, тучные клетки, миелоидные клетки, нейтрофильные лейкоциты, остеокласты, активированные тромбоциты, B- и T-клетки. (+) – (патология): острые миелолейкозы M4/M5, ангиосаркома, B-клеточная лимфома, гигантоклеточная ангиобластома, волосатоклеточный лейкоз, гистиоцитарная саркома, гистиоцитоз клеток Лангерганса, мастоцитоз, меланомы (некоторые).
CD69
Маркёр активации клеток гемопоэтической линии развития, наиболее ранний активационный антиген T-лимфоцитов (OMIM 107273). Гомодимер (молекулярная масса 23 кДа) с дисульфидной связью (12р13). (+) – (норма): активированные T-клетки, B-клетки, NK-клетки, нейтрофильные лейкоциты, эозинофилы, эпидермальные клетки Лангерганса. (+) – (патология): T-клеточные лимфомы.
CD70
CD27L, TNFSF7. Принадлежит к суперсемейству лигандов ФНО (OMIM 602840), лиганд для CD27 (19р13). Молекулярная масса 75- 170 кДа. (+) – (норма): активированные B- и T-клетки, макрофаги. (+) – (патология): клетки Рид-Штернберга.
CD71
TFRC, TFR, TRFR. Рецептор для трансферрина (OMIM 190010).
Трансмембранный гликопротеин, состоящий из двух идентичных
мономеров (молекулярной массой 90-95 кДа каждый), соединённых дисульфидной связью. (+) – (норма): все пролиферирующие клетки, нуждающиеся в железе: эритроидные предшественники костного мозга, ретикулоциты, эндотелий мозга. (+) – (патология): острые миелолейкозы M6.
CD72
Общий B-клеточный маркёр (9р13.1). Экспрессируется начиная с про-B-клеток. Молекулярная масса 45 кДа. Характеризуют как ингибиторный рецептор B-лимфоцитов. (+) – (норма): B-клетки. (+) – (патология): волосатоклеточный лейкоз.
CD73
NT5E, E5NT, ENT, NTE. Экто-5′-нуклеотидаза (6q14-q21). Молекулярная масса 69-72 кДа. (+) – (норма): субпопуляции T-клеток (CD3 – 25%, CD4 – 10%, CD8 – 50%) и B-клеток (75%), эндотелий, ФДК, эпителиальные клетки. (+) – (патология): хронический лимфолейкоз, острый лимфолейкоз.
CD74
HLADG. Трансмембранная инвариантная цепь Ii, выполняющая роль шаперона при внутриклеточном транспорте молекул HLA класса II в АПК (5q32). Имеет изоформы с молекулярной массой 33 кДа, 35 кДа и 41 кДа. Участвует во внутриклеточной укладке и сборке образующихся a- и Р-цепей HLA-DR. Является рецептором для цитокина MIF (Macrophage migration Inhibitory Factor – фактор подавления миграции макрофагов). (+) – (норма): B-клетки, активированные T-клетки, макрофаги, активированные эндотелиальные и эпителиальные клетки.
CD75
Лактозамин, член семейства сиалогликанов, лиганд для CD22. (+) – (норма): B-клетки, некоторые эпителиальные клетки, эритроциты. (+) – (патология): «popcorn»-клетки при болезни Ходжкина.
• CD75s – α2,6-сиалированный лактозамин (ранее назывался CDw75 или CDw76). Лиганд для CD22. (+) – (норма): зрелые В-клетки, в особенности клетки зародышевых центров, небольшая часть T-лимфоцитов.
CDw76
Переименован в CD75s.
Глоботриасиалцерамид (антиген группы крови Pk) – связывается с токсином Shigella dysenteriae, веротоксином 1 E. coli, CD19. (+) – (норма): B-клетки. (+) – (патология): лимфома Беркитта.
CD78
Также известный как CDw78, Ba-антиген, Leu21 или LO-panB-a. Присутствует на некоторых незрелых и на некоторых зрелых В-клетках. Его экспрессия значительно усиливается после активации В-клеток in vitro. Он также обнаружен на тканевых макрофагах и на эпителиальных клетках, но не на Т-лимфоцитах, NK-клетках, моноцитах и гранулоцитах. Антиген CDw78 экспрессируется как часть одной из молекул, кодируемых генами МНС класса II, и является сходной (если не идентичной) с α/β-гетеродимерным антигеном МНС-II.
CD79
• CD79a – инвариантный компонент Igα BCR (OMIM 112205; 19q13.2). Молекулярная масса 40-45 кДа. Участвует в трансдукции внутриклеточного сигнала. (+) – (норма): B-клетки. (+) – (патология): B-клеточные лимфомы, лимфома Ходжкина.
• CD79b – инвариантный компонент Igβ BCR (OMIM 147245; 17q23). Молекулярная масса 37 кДа. Участвует в трансдукции внутриклеточного сигнала.
CD80
B7.1, B71, BB1. Трансмембранный гликопротеин суперсемейства иммуноглобулинов (OMIM 112203; 3q13.3-q21). Молекулярная масса 60 кДа. Лиганд для CD28 и для CD152 (CTLA-4) T-клеток, необходимый для их активации (через CD28) и торможения активации (через CD152). Участвует в T-B-взаимодействии и в «диалоге» T-лимфоцитов с АПК. (+) – (норма): активированные B-клетки, T-клетки, макрофаги, ДК.
CD81
TAPA-1 (Targetof AntiProliferative Antibody). Мишень для антипролиферативных антител – интегральный мембранный белок (OMIM 186845; 11p15.5) суперсемейства тетраспанинов. Молекулярная масса 26 кДа. Экспрессируется разными клетками (в том числе лимфоцитами, тимоцитами, частью макрофагов, гранулоцитами). Участвует в процессах роста, развития, подвижности, во взаимодействии и активации клеток. Связывается, в частности, с белками оболочки вируса гепатита C. CD81 входит в состав комплекса с CD19, физически и функциональ-
но связан с отдельными интегринами, взаимодействует с молекулами HLA класса II.
CD81P3
См. CD316.
CD82
Антиген суперсемейства тетраспанинов с четырьмя трансмембранными доменами, разделёнными двумя внеклеточными петлями, и двумя короткими цитоплазматическими сегментами (11р11.2). Молекулярная масса 45-90 кДа. Участвует в активации T-клеток – пролиферация, выработка цитокинов и др. (OMIM 600623). Образует кластеры с CD63, защищающие молекулы HLA класса II от действия протеаз. (+) – (норма): активированные/дифференцированные гемопоэтические клетки. (-) – эритроциты.
CD83
Трансмембранный белок суперсемейства иммуноглобулинов c цитоплазматическим сегментом и одним внеклеточным доменом (6р23). Молекулярная масса 43 кДа. Основной маркёр зрелых ДК (OMIM 604534). Экспрессируется также на активированных B-лимфоцитах, клетках Лангерганса. CD83 связывается с моноцитами и служит рецептором адгезии клеток семейства SIGLEC (OMIM 600751). (+) – (норма): ДК, клетки Лангерганса, лимфоциты. (+) – (патология): воспалительный инфильтрат миокарда при синдроме Чёрджа-Стросс.
CD84
Молекула адгезии (OMIM 604513) суперсемейства иммуноглобулинов (1q24). Молекулярная масса 68-80 кДа. (+) – (норма): B-клетки, тимоциты, некоторые T-клетки, моноциты/макрофаги, тромбоциты.
CD85
Семейство иммуноглобулиноподобных рецепторов ILT/LIR/MIR (Immunoglobulin-Like Transcript/Leukocyte Immunoglobulin-like Receptor/ Macrophage Immunoglobulin-like Receptor). Принадлежит к суперсемейству иммуноглобулинов, кодируется генами лейкоцитарного кластера LRC (Leukocyte Receptor Cluster), (19q13.4). Включает рецепторы как активирующего (ILT1/LIR7, LIR6, ILT7, ILT8), так и ингибирующего типов (ILT2/LIR1/MIR7, ILT3/LIR5, ILT4/LIR2/MIR10, ILT5/LIR3, LIR8). (+) – (норма): миелоидные клетки, B-лимфоциты, NK-клетки, часть T-лимфоцитов. (+) – (патология): клетки волосатоклеточного лейкоза.
• CD85a (ILT5, LIR3) (OMIM 604820).
• CD85b (ILT8).
• CD85c (LIR8) (OMIM 604814).
• CD85d (ILT4, LIR2, MIR10) (OMIM 604815).
• CD85e (ILT6, LIR4) (OMIM 604818).
• CD85f (ILT11) (OMIM 606047).
• CD85g (ILT7).
• CD85h (ILT1, LIR7) (OMIM 604812).
• CD85i (LIR6) (OMIM 604810).
• CD85j (ILT2, LIR1, MIR7) (OMIM 604811).
• CD85k (ILT3, LIR5) (OMIM 604821).
• CD851 (ILT9).
• CD85m (ILT10).
CD86
B7.2. Одноцепочечный гликопротеин суперсемейства иммуноглобулинов (3q21). Молекулярная масса 80 кДа. Содержит внеклеточный и трансмембранный домены и цитоплазматический участок. Связывается с CTLA-4 на T-лимфоцитах. Взаимодействуя с лигандом CD28, формирует одну из двух пар костимулирующих молекул, необходимых для активации T-хелперов и стимуляции АПК. (+) – (норма): ДК в T-зонах, клетки Лангерганса, B-клетки памяти, моноциты, эндотелий, активированные T-клетки.
CD87
PLAUR, uPAR. Рецептор активатора плазминогена урокиназный (OMIM 173391; 19q13). Молекулярная масса 35-39 кДа. (+) – (норма): T-клетки, NK-клетки, моноциты, нейтрофильные лейкоциты, эндотелий, фибробласты, гладкие мышцы, кератиноциты, плацента, гепатоциты. (+) – (патология): карциномы молочной железы, толстой кишки и простаты, меланома.
CD88
Рецептор для компонента комплемента, анафилатоксина и хемоаттрактанта C5a; гликопротеин семейства G-связывающих белков (19q13.3-q13.4). Молекулярная масса 43 кДа. Связывается с CD222; участвует в индукции синтеза белков острой фазы. (+) – (норма): гранулоциты, нейтрофилы, макрофаги/моноциты, ДК, тучные клетки, гепатоциты, астроциты, микроглия.
FcaRI. Рецептор типа I для Fc-фрагмента IgA (OMIM 147045), гликопротеин суперсемейства иммуноглобулинов (19q13.2-q13.4). Включает 2 внеклеточных домена, трансмембранный домен и цитоплазматический участок. Молекулярная масса 45-100 кДа. (+) – (норма): гранулоциты, моноциты, активированные эозинофилы, альвеолярные макрофаги.
CD90
Thy-1. Маркёр ранних гемопоэтических клеток-предшественников, гликопротеин суперсемейства иммуноглобулинов (11q22.3-q23). Молекулярная масса 25-35 кДа. (+) – (норма): гемопоэтические стволовые клетки, нейроны, соединительная ткань.
CD91
Рецептор для α2-микроглобулина (12q13-q14). Димер с молекулярной массой цепей 515 кДа и 85 кДа. Относится к семейству рецепторов липопротеинов низкой плотности. (+) – (норма): фибробласты, ДК, макрофаги; печень, мозг, лёгкие.
CD92
Переносчик холина (9q31.2). Возможно, участвует в мембранном синтезе SLC44A1 – холин-транспортирующего-подобного белка 1. Молекулярная масса 70 кДа. (+) – (норма): лейкоциты, эндотелий.
CD93
C1QR1. Компонент комплемента 1 q, субкомпонент рецептора 1. Рецептор (или элемент большего рецепторного комплекса) для C1q, MBL (MBL2) и белка легочного сурфактанта А (SPA). Может быть медиатором усиления фагоцитоза в моноцитах и макрофагах за счёт взаимодействия с растворимыми защитными коллагенами. Может участвовать в межклеточной адгезии. (+) – (норма): гранулоциты, моноциты, тромбоциты, нейтрофилы, клетки эндотелия. (+) – (патология): бласты при остром миелолейкозе.
CD94
Член подсемейства лектиноподобных рецепторов типа D для молекул MHC-I. Содержат внеклеточный участок с лектиновым доменом типа С (12р13). Молекулярная масса 43 кДа. На поверхности NK-клеток и части T-лимфоцитов экспрессируется в виде гетеродимера, ковалентно связанного с рецептором семейства NKG2 (CD94/NKG2). Способен как активировать прохождение внутриклеточного сигнала (CD94/
NKG2C, CD94/NKG2E, CD94/NKG2H), так и подавлять его (CD94/
NKG2A, CD94/NKG2В). Активирующие и ингибирующие свойства рецептора определяются структурным строением их трансмембранных и цитоплазматических доменов – связью с ITAM-содержащим адапторным белком DAP12 (активирующие рецепторы) или наличием двух доменов ITIM (ингибирующие рецепторы). (+) – (норма): NK-клетки, некоторые T-клетки.
CD95
Fas/APO-1, TNFRSF6. Мембранный рецептор для Fas-лиганда (CD95L или CD178). Относится к суперсемейству рецепторов фактора некроза опухоли (OMIM 134637; 10q24.1). Молекулярная масса 160 кДа. CD95 характеризуют как рецептор смерти – DR (Death Receptor), содержащий в цитоплазматической части домен смерти DD (Death Domain) – центральный физиологический регулятор апоптоза. (+) – (норма): лимфоидная ткань, печень, лёгкие, молочная железа, эпителий влагалища, матки, яичников. (+) – (патология): эпителий щитовидной железы при тиреоидите Хасимото, клетки Рид-Штернберга, пищевод Баррета, аденокарцинома пищевода.
CD96
TACTILE (T cell Activation, Increased Late Expression). Антиген повышенной поздней экспрессии на активированных T-клетках (3q13.13). Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 160 кДа. (+) – (норма): активированные T-клетки, NK-лимфоциты.
CD97
(OMIM 601211; 19р13.2-р13.12). Гликопротеин семейства G-связывающих белков. Молекулярная масса (в зависимости от изоформы) 28-89 кДа. Связывается с лигандом CD55 (фактор DAF, ускоряющий разрушение комплемента). (+) – (норма): активированные T- и B-клетки, моноциты/макрофаги, ДК, гранулоциты. (+) – (патология): клетки карцином щитовидной железы и органов пищеварения.
CD98
SLC3A2. Активатор транспорта двухосновных и нейтральных аминокислот (11q13). Гетеродимер с соединёнными дисульфидной связью цепями: тяжёлой гликозилированной (80 кДа) и лёгкой негликозилированной (45 кДа). Связывается с актином. (+) – (норма): многие клетки. (+) – (патология): трансформированные опухолевые клетки.
MIC2, MIC2X, O13 (OMIM 313470; Xp22.32-Yp11.3). Гликопротеин клеточной поверхности. Молекулярная масса 32 кДа. Участвует в процессах адгезии T-лимфоцитов. (+) – (норма): тимоциты, лимфоциты периферической крови, клетки гранулёзы яичника, островки Лангерганса, клетки Сертоли. (+) – (патология): T-клеточный острый лимфолейкоз, саркома Юинга/недифференцированная нейроэктодермальная опухоль (95%), многие карциномы и стромальные опухоли.
CD100
SEMA4D, SEMAJ, COLL4. Гомодимер с молекулярной массой 300 кДа (9q22-q31). Относится к семейству семафоринов и к суперсемейству иммуноглобулинов. Содержит несколько доменов, в том числе трансмембранный и цитоплазматический – семафорин 4D (коллапсин 4; OMIM 601866). (+) – (норма): гемопоэтические клетки.
CD101
IGSF2. Гликопротеин суперсемейства иммуноглобулинов (OMIM 604516; 1р13). Молекулярная масса 240 кДа. Участвует в активации T-клеток. (+) – (норма): моноциты, гранулоциты, ДК, активированные T-лимфоциты.
CD102
ICAM-2 (Intercellular Adhesion Molecule 2). Молекула межклеточной адгезии 2 (17q23-q25). Молекулярная масса 55-65 кДа. Трансмембранный гликопротеин суперсемейства иммуноглобулинов. Связывает LFA-1 (CD11a/CD18), участвует в процессах рециркуляции лимфоцитов, активации NK-клеток, в адгезивных взаимодействиях при иммунном ответе; проявляет костимулирующую активность для T-клеток. (+) – (норма): моноциты, тромбоциты, часть покоящихся лимфоцитов, эндотелий сосудов. (+) – (патология): некоторые лимфомы.
CD103
ITGAE. α-Субъединица интегрина Е (интегрин αE) (OMIM 604682; 17р13). Маркёр внутриэпителиальных лимфоцитов. Лиганды: интегрин β7, Е-кадгерин. (+) – (норма): внутриэпителиальные лимфоциты, некоторые T-лимфоциты слизистой оболочки кишечника. (+) – (патология): волосатоклеточный лейкоз; острый миелолейкоз, а также T-клеточные лимфомы, связанные с энтеропатиями.
β4-Субъединица интегрина (интегрин β4). (+) – (норма): тимоциты, эпителий, эндотелий, нейроны.
CD105
ENG. Эндоглин (OMIM 131195). Гомодимерный гликопротеин молекулярной массой 180 кДа (9q33-q34.1). Служит регуляторной частью рецептора для ТФРР. Лиганды: ТФРР1, ТФРР3. (+) – (норма): активированные моноциты, макрофаги, эндотелий, эритроидные предшественники; синцитиотрофобласт, цитотрофобласт.
CD106
VCAM-1 (Vascular Cell Adhesion Molecule 1). Молекула адгезии сосудистых клеток, сиалогликопротеин, член суперсемейства иммуноглобулинов (1p32-p31). Молекулярная масса 100-110 кДа. Опосредует адгезию между лейкоцитами и клетками эндотелия. Лиганд: VLA-4 (CD49d).
CD107
Ассоциированные с мембраной лизосом гликопротеины. Молекулярная масса 110-120 кДа. (+) – (норма): тромбоциты, активированные T-клетки, нейтрофильные лейкоциты, эндотелий.
• CD107a (LAMP-1 – Lysosome-Associated Membrane Protein 1)
(13q34).
• CD107b (LAMP-2) (Xq24).
CD108
SEMA7A. Ранее назывался CDw108. Семафорин, мембранный гликопротеин (15q22.3-q23). Молекулярная масса 76 кДа. Антиген группы крови John-Milton-Hagen (JMH). (+) – (норма): эритроциты, лимфобласты, лимфоциты.
CD109
ФАТ, гликопротеин с молекулярной массой 175 кДа. Экспрессируется на тромбоцитах, активированных T-лимфоцитах, клетках эндотелия.
CD110
TPO-R, MPL. Рецептор для тромбопоэтина (1р34). Член суперсемейства иммуноглобулинов. Молекулярная масса 85-92 кДа. Опосредует образование и стимуляцию функций мегакариоцитов, дифференцировку тромбоцитов, защищает стволовые клетки от апоптоза. (+) – (норма): СКК, мегакариоциты, тромбоциты.
PRR1. Белок адгезии нектин 1 (11q23-q24). Имеет 3 изоформы – нектин 1α (50 кДа, мембраносвязанный), 15 (57 кДа, мембраносвязанный) и нектин 1 γ (39 кДа, секретируемый). Служит рецептором для вирусов простого герпеса 1 и 2. (+) – (норма): клетки миелоидной, моноцитарной, эритроидной и мегакариоцитарной линий; эпителиальные клетки, нейроны, эндотелий.
CD112
PRR2. Молекула адгезии (19q13.2-q13.4). Имеет 2 изоформы – CD112a (64 кДа) и CD1125 (75 кДа). Служит рецептором для псевдорабического вируса и для отдельных мутантов вируса герпеса. (+) – (норма): клетки миелоидной, моноцитарной, эритроидной и мегакариоцитарной линий, эпителиальные клетки, нейроны, эндотелий.
CD113
PRR3. Нектин 3. Молекула адгезии эпителиальных клеток. Принадлежит к суперсемейству иммуноглобулинов.
CD114
G-CSFR. Рецептор для G-CSF (1р35-р34.3). Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 130 кДа. Специфический регулятор процессов пролиферации и дифференцировки клеток миелоидного ряда. (+) – (норма): гранулоциты, моноциты, тромбоциты, эндотелий, плацента, клетки трофобласта. (+) – (патология): культивируемые опухолевые клетки.
CD115
c-fms. Рецептор для M-CSF (5q33.2-q33.3). Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 150 кДа. Опосредует действие M-CSF на клетки мононуклеарных фагоцитов (рост, активацию, выживаемость). CD115 характеризуют как рецепторную тирозинкиназу. (+) – (норма): макрофаги, остеокласты, трофобласт, молочная железа, микроглия, нейроны, астроциты. (+) – (патология): 10% острых миелолейкозов, некоторые карциномы эндометрия, яичника и молочной железы, а также клетки хориокарциномы.
CD116
GM-CSFR. α-Субъединица рецептора GM-CSF (Xp22.32, Yp11.3). Молекулярная масса 80 кДа. Взаимодействует с общей β-субъединицей (CD131) рецепторов для GM-CSF, ИЛ-3 и ИЛ-5. (+) – (норма): макрофаги, нейтрофилы, эозинофилы, фибробласты, эндотелий, ДК.
с-kit. Рецептор фактора стволовых клеток (SCF – Stem Cell Factor) (4q11-q12). Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 145 кДа. Участвует в регуляции гемопоэза. Лиганды: SCF, фактор роста тучных клеток. (+) – (норма): гемопоэтические стволовые клетки, меланоциты, мозг эмбриона и плода, эндотелий, тучные клетки, гонады, молочная железа, интерстициальные клетки Кахаля, гоноциты. (+) – (патология): острые миелолейкозы, ангиосаркомы (50%), светлоклеточная саркома, хронический миелолейкоз, эпителиоидная саркома, саркома Юинга, гранулоцитарная саркома, лимфомы, семиномы, герминомы.
CD118
LIFR – Leukemia Inhibitory Factor Receptor a. Гликопротеин типа I. Растворимый CD118 обнаружен в сыворотке, его уровень возрастает во время беременности. (+) – (норма): гемопоэтические стволовые клетки, эпителиальные клетки, моноциты, фибробласты, печень, плацента.
CD119
IFNGR1 – Interferon Gamma Receptor 1. a-Цепь рецептора для ИФНу (6q23-q24). Высокоаффинный рецептор к ИНФу. Гетеродимер, состоящий из двух цепей, – α (54 кДа; собственно CD119 или IFNGR1; связывает лиганд – ИНФу) и β (38 кДа; (21q22.11); IFNGR2; передаёт сигнал в клетку). (+) – (норма): моноциты/макрофаги, B-клетки. NK-клетки, эндотелий.
CD120
TNF-R – Tumor Necrosis Factor Receptor. Рецептор для ФНО. Относится к семейству рецепторов смерти DR (Death Receptor). Опосредует провоспалительный ответ. Экспрессируется на гемопоэтических и негемопоэтических клетках.
• CD120a (p55/60, TNF-RI) – рецептор типа I для ФНОα и ФНОβ (12р13.2). Молекулярная масса 55 кДа. Участвует в запуске апоптоза. Цитоплазматический участок рецептора содержит домен смерти DD (Death Domain).
• CD120b (p75/80, TNF-RII) – рецептор типа II для ФНОα и ФНОβ (1p36.3-p36.2). Молекулярная масса 75 кДа. Сигналы, индуцирующие апоптоз, непосредственно не запускает. Цитоплазматический участок лишён домена смерти DD.
Рецептор ИЛ-1. Принадлежит к суперсемейству иммуноглобулинов.
• CD121a – рецептор типа I (2q12). Связывает все формы ИЛ-1, способен к передаче активирующего внутриклеточного сигнала. Молекулярная масса 80 кДа. (+) – (норма): T-клетки, тимоциты, фибробласты, эндотелий, гепатоциты, кератиноциты, астроциты.
• CDw121b – рецептор типа II (2q12-q22). Является ловушкой для ИЛ-1, блокирует эффекты, связанные с его повышенной выработкой. Молекулярная масса 68 кДа. (+) – (норма): B-клетки, моноциты/макрофаги, нейтрофилы, клетки костного мозга.
CD122
IL2RB. Р-Цепь рецепторов для ИЛ-2 и для ИЛ-15 (OMIM 146710;
22q13.1). Молекулярная масса 75 кДа. Вместе с у-цепью (CD132) формирует рецептор для ИЛ-2, а вместе с IL15RA входит в состав рецептора для ИЛ-15. (+) – (норма): B- и T-лимфоциты, NK, моноциты, макрофаги.
CD123
IL3RA. Низкоаффинная α-цепь рецептора для ИЛ-3 (OMIM 308385). Вместе с β-цепью (CD131) формирует высокоаффинный рецептор. Служит маркёром плазмоцитоидных ДК (фенотипа CD123+ CD11c+).
CD124
Общая α-субъединица рецептора ИЛ-4 и ИЛ-13 (16р11.2-12.1). Гликопротеин. Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 140 кДа. Вместе с у-цепью (CD132) формирует рецептор для ИЛ-4, а вместе с цепью α1 (CD213a1) – рецептор для ИЛ-13. (+) – (норма): гемопоэтические и негемопоэтические клетки (фибробласты, нейробласты, клетки стромы, эндотелий, эпителий, мышечные клетки, кератиноциты, гепатоциты).
CD125
Низкоаффинный рецептор ИЛ-5, α-цепь высокоаффинного рецептора ИЛ-5 [формирует его вместе с β-цепью (CD131)] (3р26-р24). Белок суперсемейства иммуноглобулинов. Молекулярная масса 55-60 кДа. (+) – (норма): эозинофилы, активированные B-клетки, базофилы.
CD126
IL6RA. α-Цепь рецептора ИЛ-6 (OMIM 147880; 1q21). Вместе с β-цепью (CD130) формирует рецептор, α-цепь которого связывает интерлейкин, а β-цепь обеспечивает передачу активирующего сигнала
внутрь клетки. Одноцепочечный гликопротеин суперсемейства иммуноглобулинов с внеклеточным, трансмембранным и внутриклеточным сегментами. Молекулярная масса 80 кДа. (+) – норма: плазматические клетки, T-лимфоциты и активированные B-клетки, моноциты, гепатоциты.
CD127
α-Цепь рецептора ИЛ-7 (5p13). Вместе с γ-цепью (CD132) формирует высокоаффинный рецептор для ИЛ-7. Гликопротеин суперсемейства иммуноглобулинов. Молекулярная масса 65-90 кДа. (+) – (норма): предшественники B-клеток, большинство T-клеток, моноциты.
CDw128a
Переименован в CD181.
CDw128b
Переименован в CD182.
CD129
Трансмембранный белок типа I. Индуцирует рост клеток и/или их дифференцировку. (+) – (норма): некоторые Т-клетки, миелоидные и эритроидные предшественники, а также тучные клетки. (+) – (патология): болезнь Ходжкина, большеклеточные лимфомы и мегакариобластические лейкозы.
CD130
gp130 (5q11). Общая β-субъединица, входящая в качестве трансдуктора сигналов в состав ряда рецепторов цитокинов – ИЛ-6 и ИЛ-11, лейкозингибирующего фактора (LIF), онкостатина М (OSM), цилиарного нейротропного фактора, кардиотропина-1. CD130 непосредственно связывается только с OSM, а с другими лигандами – в составе комплекса, например, с ИЛ-6 взаимодействует комплекс CD126/CD130. CD130 принадлежит к суперсемейству иммуноглобулинов. Одноцепочечная трансмембранная молекула. Молекулярная масса 130-140 кДа. (+) – (норма): практически все типы клеток.
CD131
Ранее известен как CDw131. Общая Р-субъединица рецепторов ИЛ-3, ИЛ-5 и GM-CSF (22q13.1). Трансмембранный гликопротеин суперсемейства иммуноглобулинов. Молекулярная масса 120-140 кДа. (+) – (норма): миелоидные клетки, ранние B-клетки.
IL2RG. Общая у-цепь рецепторов интерлейкинов (ИЛ-2, ИЛ-4, ИЛ-7, ИЛ-9, ИЛ-15 и ИЛ-21). Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 64 кДа (Xq13.1). (+) – (норма): Tи B-лимфоциты, NK-клетки, моноциты/макрофаги, нейтрофильные лейкоциты, тучные клетки.
CD133
Гликопротеин. Относится к пентаспанинам семейства промининов (4р16.2-р12). Молекулярная масса 120 кДа. Маркёр родоначальных и гемопоэтических стволовых клеток. (+) – (норма): ранние родоначальные клетки, включая CD34+ гемопоэтические клетки-предшественники, нейральные и эндотелиальные стволовые клетки. (+) – (патология): ретинобластома, гемангиобласты.
CD134
TNFRSF4, OX40. Белок суперсемейства рецепторов для фактора некроза опухоли (OMIM 600315; 1q36). Молекулярная масса 50 кДа. Стимулирует адгезивные взаимодействия клеток, экспрессируется на активированных T-лимфоцитах.
• CD134L (TNFSF4, OX40L, OMIM 603594) – лиганд для ОХ40.
Bзаимодействие Т- и В-лимфоцитов, опосредованное CD134 и CD134L, сопровождается активацией выработки IgG.
CD135
Flt3. Рецептор фактора роста ранних родоначальных гемопоэтических клеток (13q12). Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 130 кДа. (+) – (норма): полипотентные СКК. (+) – (патология): большинство острых миелолейкозов, острых лимфолейкозов и хронических миелолейкозов.
CD136
Рецептор белка, стимулирующего макрофаги (MSP – Macrophage Stimulating Protein) (3р21.3). Относится к семейству протеинкиназ. Гетеродимер с дисульфидными связями, состоящий из внеклеточной a-цепи (40 кДа) и Р-цепи (150 кДа) с внеклеточным и трансмембранным сегментами и внутриклеточным тирозинкиназным доменом. (+) – (норма): эпителий кожи, почек, лёгкого, печени, кишечника; моноциты, отдельные гемопоэтические и нейроэндокринные клетки.
TNFRSF9, ILA. Член суперсемейства рецепторов фактора некроза опухоли (OMIM 602250; 1р36). Гликопротеин с внеклеточным, трансмембранным и внутриклеточным фрагментами. Проявляет свойства костимулирующей молекулы или молекулы, передающей внутриклеточный активирующий сигнал. (+) – (норма): NK-клетки, внутриэпителиальные лимфоциты, эозинофилы, тимоциты, активированные T-лимфоциты (CD4+ и CD8+) – особенно CD45RA и CD45RО; B-клетки, моноциты, эпителиальные клетки.
CD138
Syndecan-1. Синдекан 1 (OMIM 186355; 2р24.1). Мембранный протеогликан, функционирующий как рецептор для внеклеточного матрикса. (+) – (норма): маркёр B-лимфоцитов, дифференцирующихся на стадии после миграции из зародышевых центров; высокоспецифичный маркёр плазматических клеток, представлен на поверхности эндотелиальных и многих других типов клеток. (+) – (патология) – отдельные B-клеточные лимфомы.
CD139
Молекулярная масса 209-228 кДа. (+) – (норма): B-лимфоциты, моноциты, гранулоциты, ФДК.
CD140
Рецептор для фактора роста, продуцируемый тромбоцитами (PDGFR – Platelet Derived Growth Factor Receptor).
• CD140a (PDGFRα).
• CD140b (PDGFRβ).
(+) – (норма): фибробласты, клетки гладких мышц, клетки глии и хондроциты.
CD141
Тромбомодулин – кофактор, активирующий белок С и участвующий в развитии противосвёртывающего каскада. Относится к семейству лектинов типа С. Одноцепочечный гликопротеин с внеклеточным, трансмембранным и внутриклеточным регионами. Молекулярная масса 75 кДа. (+) – (норма): эндотелий, мегакариоциты, кератиноциты, мезотелий, моноциты, нейтрофильные лейкоциты, тромбоциты, гладкие мышцы, синцитиотрофобласт, синовиальная оболочка, уротелий. (+) – (патология): мезотелиома (эпителиоидная), плоскоклеточные карциномы, опухоли трофобласта, уротелиальная карцинома, сосуди-
стые опухоли, синовиальная саркома. (-) – (патология): аденокарцинома толстой кишки, эндометрия, почки, простаты.
CD142
Главный тканевой фактор коагуляции (фактор III), или тромбопла-
стин – одноцепочечный белок с внеклеточным, трансмембранным и внутриклеточным фрагментами (1р22-р21). Молекулярная масса 45- 47 кДа. Связывает фактор VIIa свёртывания крови. В соотношении 1:1 комплекс CD142/VIIa активирует факторы свёртывания крови (VII, IX и X) и запускает этот каскад. (+) – (норма): эпидермальные кератиноциты, различные эпителии, адвентициальные клетки кровеносных сосудов, астроциты, миокард, шванновские клетки, клетки стромы печени, поджелудочной железы, селезёнки.
CD143
Ангиотензинпревращающий фермент – заякоренный в клеточной мембране член семейства пептидаз М2 (17q23). Молекулярная масса 110-180 кДа. Вовлекает в метаболизм вазоактивные пептиды брадикинин и ангиотензин II, участвует в связывании сперматозоидов с яйцеклеткой. (+) – (норма): эндотелий артериол, эндотелий капилляров лёгкого, щёточная каёмка проксимальных извитых канальцев, клетки гранулёзы, клетки Лейдига.
CD144
Кадгерин-5. Участвует в межклеточных контактах эндотелия. (+) – (норма): эндотелий, мозг.
CDw145
Экспрессируется на эндотелиальных клетках; другая информация в настоящее время отсутствует.
CD146
Молекула адгезии клеток меланомы (11q23.3). Член суперсемейства иммуноглобулинов. Молекулярная масса 118 кДа. Участвует в процессах роста и расселения опухолевых клеток. (+) – (норма): гладкие мышцы, эндотелий, трофобласт, часть активированных T-клеток, шванновские клетки. (+) – (патология): светлоклеточная саркома (90%), лейомиосаркома, меланома, нейрофиброма (40%), аденокарцинома простаты.
CD147
Нейротелин (19p13.3). Одноцепочечная молекула адгезии суперсемейства иммуноглобулинов с внеклеточным, трансмембранным и
цитоплазматическим участками. Молекулярная масса 50-60 кДа. (+) – (норма): лейкоциты, эритроциты, тромбоциты, эндотелий.
CD148
Одноцепочечный трансмембранный рецептор с протеинтирозинфосфатазным доменом в цитоплазматической части (11p.11.2). Молекулярная масса 240-260 кДа. (+) – (норма): гранулоциты, моноциты, T-клетки памяти, ДК, тромбоциты, фибробласты, нейроны, клетки Купфера.
CDw149
Переименован в CD47R.
CD150
Костимулирующий рецептор – одноцепочечная трансмембранная молекула суперсемейства иммуноглобулинов (1q22-q23). Молекулярная масса 65-95 кДа. (+) – (норма): тимоциты, T-клетки фенотипа CD45RO, B-клетки, ДК, эндотелий.
CD151
Трансмембранная молекула семейства тетраспанинов (PETA3, SFA1) (OMIM 602243; 11р15.5). Молекулярная масса 32 кДа. (+) – (норма): эндотелий, тромбоциты, мегакариоциты, эпителий.
CD152
CTLA-4 (Cytotoxic T Lymphocyte-Associated antigen 4). Гликопротеин цитотоксических T-лимфоцитов 4 (OMIM 123890; 2q33). Гомодимер с дисульфидными связями. Принадлежит к суперсемейству иммуноглобулинов. Характеризуют как ингибиторный рецептор T-клеток, лиганд для В7-1 (CD80) и В7-2 (CD86). Молекулярная масса 33 кДа. (+) – (норма): активированные T-клетки, некоторые активированные B-клетки.
CD153
CD30L, TNFSF8, CD30LG. Член суперсемейства фактора некроза опухоли (OMIM 603875; 9q33) – лиганд для CD30. Трансмембранная молекула молекулярной массой 38-40 кДа. Экспрессируется на макрофагах, нейтрофильных лейкоцитах, активированных T- и B-лимфоцитах.
CD154
CD40L, gp39. Член суперсемейства фактора некроза опухоли (OMIM 300386; Xq26) – лиганд для CD40. Трансмембранная молекула молекулярной массой 32-39 кДа. Взаимодействие CD154+ T-лимфоцитов с CD40+ АПК – важнейший этап развития гу-
морального и клеточного иммунного ответа. CD154 необходим для формирования B-клеток памяти. (+) – (норма): преимущественно активированные зрелые CD4+ T-клетки, небольшая часть активированных CD8+ T-лимфоцитов.
CD155
PVR. Рецептор для вируса полиомиелита (OMIM 173850; 9q13.2). Молекулярная масса 80-90 кДа. Участвует в процессах межклеточной адгезии. (+) – (норма): тимоциты, моноциты, макрофаги, нейроны.
CD156a
ADAM4 (OMIM 602267; 10q26.3). Относится к семейству металлопротеаз-дезинтегринов. Молекулярная масса 69 кДа. (+) – (норма): нейтрофильные лейкоциты, моноциты.
CD156b
TACE (Tumor necrosis factor Alpha Converting Enzyme). Фермент, конвертирующий ФНОα, – многодоменный трансмембранный белок семейства металлопротеаз-дезинтегринов (2p25). Молекулярная масса 100-120 кДа. (+) – (норма): все клетки.
CD157
АДФ-рибозилциклаза и гидролаза для АДФ-рибозы – одноцепочечная молекула, заякоренная в G-белке (OMIM 600387; 4р15). Молекулярная масса 42-50 кДа. (+) – (норма): гранулоциты, моноциты, макрофаги, предшественники B-клеток, часть T-клеток, ФДК, линии стромальных клеток костного мозга.
CD158
KIR (Killer Immunoglobulin-like Receptors). Иммуноглобулиноподобные рецепторы NK-клеток. Контролируются генами кластера LRC (Leukocyte Receptor Cluster) хромосомы 19 (19q13.4). Гликопротеины клеточной поверхности, несущие 2 или 3 внеклеточных домена (KIR2D или KIR3D соответственно). KIR характеризуют как активирующие или ингибирующие рецепторы. Активирующие имеют короткий (индекс «S» в наименовании – от англ. Short; KIR2DS или KIR3DS), а ингибирующие – длинный цитоплазматический сегмент (индекс «L» в наименовании – от англ. Long; KIR2DL или KIR3DL). Следующая цифра означает номер рецептора. Рецепторы типа «S» взаимодействуют положительно заряженным коротким цитоплазматическим сегментом с отрицательно заряженным адапторным белком DAP12, несущим домены ITAM и участвующим в активации клетки. Рецепторы типа «L» в цитоплаз-
матическом сегменте содержат домены ITIM c функцией подавления клеточной активности. Лиганды: MHC-I. (+) – (норма): NK-клетки, некоторые T-клетки.
• CD158a (KIR2DL1, OMIM 604936).
• CD158b1 (KIR2DL2, OMIM 604937).
• CD158b2 (KIR2DL3, OMIM 604938).
• CD158c (KIR2DS6/KIRX).
• CD158d (KIR2DL4, OMIM 604945).
• CD158e1 (KIR3DL1, OMIM 604946).
• CD158e2 (KIR3DS1, OMIM 604957).
• CD158f (KIR2DL5, OMIM 605305).
• CD158g (KIR2DS5, OMIM 604956).
• CD158h (KIR2DS1, OMIM 604952).
• CD158i (KIR2DS4, OMIM 604955).
• CD158j (KIR2DS2, OMIM 604953).
• CD158k (KIR3DL2, OMIM 604947).
• CD158z (KIR3DL7/KIRC1).
CD159a
NKG2A. Подобный лектину типа С (12p13). Принадлежит семейству рецепторов NKG2, преимущественно экспрессируемых NK-клетками. В результате ковалентного связывания с CD94 формирует ингибиторный рецептор NK-клеток – CD94/NKG2A. (+) – (норма): NK-клетки.
CD160
Гликопротеиновый мультимер с дисульфидными связями (1q42.3). Член суперсемейства иммуноглобулинов. Молекулярная масса 80 кДа. (+) – (норма): NK-клетки периферической крови, CD8+ T-клетки, внутриэпителиальные лимфоциты кишечника.
CD161
Рецептор Р1А NK-клеток – NKR-P1A (12р13). Трансмембранный гликопротеин, член семейства лектинов типа С. Молекулярная масса 80 кДа. Участвует в регуляции функций NK-клеток. (+) – (норма): NKклетки, некоторые CD4+ и CD8+ T-клетки, преимущественно клетки памяти.
CD162
PSGL-1 (P-Selectin Glycoprotein Ligand), SELPLG (Selectin P Ligand) (OMIM 600738; 12q24). Лиганд селектина Р (CD62P). Молекулярная масса 220-250 кДа. Образует связанный дисульфидной связью гомодимер,
играет ключевую роль в адгезивных взаимодействиях, опосредует перекатывание лейкоцитов по активированным, содержащим Р-селектин эндотелиальным клеткам. (+) – (норма): большинство T-клеток, некоторые B-лимфоциты, гранулоциты, моноциты.
• CD162R (PSGL-1) (12q24) – посттрансляционный вариант PSGL-1. Молекулярная масса 240 кДа. (+) – (норма): естественные киллеры.
CD163
Рецептор для гаптоглобина (OMIM 605545; 12р13.3). Принадлежит к семейству обогащённых цистеином рецепторов-«мусорщиков» SRCR. Молекулярная масса 130 кДа. (+) – (норма): моноциты/макрофаги.
CD164
Сиаломуцин; гликопротеин, подобный муцину (OMIM 603356; 6q21). Молекулярная масса 80 кДа. Участвует в процессах адгезии клеток фенотипа CD34+, а также в пролиферации гемопоэтических клеток. (+) – (норма): эпителий, моноциты, клетки стромы костного мозга. (+) – (патология): колоректальная карцинома, аденокарцинома поджелудочной железы.
CD165
Мембранный гликопротеин. Молекулярная масса 37 кДа. Участвует в процессах адгезии тимоцитов к эпителиальным клеткам тимуса. (+) – (норма): часть периферических лимфоцитов (высокий уровень экспрессии), большинство тимоцитов, клетки эпителия тимуса, моноциты, тромбоциты, нейроны центральной нервной системы (низкий уровень экспрессии). (+) – (патология): многие T-клеточные острые лимфолейкозы.
CD166
ALCAM. Молекула адгезии, связывающаяся с CD6 (3q13.1). Принадлежит к суперсемейству иммуноглобулинов, Молекулярная масса 100-105 кДа. (+) – (норма): нейроны, активированные T-клетки, активированные макрофаги, эпителий тимуса, фибробласты.
CD167a
DDR1 – рецептор с дискоидиновым доменом типа 1 (6р21.3). Принадлежит к подсемейству тирозинкиназных рецепторов. Димер с молекулярной массой 63-64 кДа. Активируется коллагеном. (+) – (норма): эпителиальные клетки (молочная железа, почка, лёгкое, пищеварительный тракт, мозг, островки Лангерганса). (+) – (патология): карциномы.
RHAMM (Receptor for Hyaluronan-Mediated Motility) – поверхностный, лишённый трансмембранного домена, рецептор для клеток с опосредованной гиалуронаном подвижностью (5q33.2). Молекулярная масса 52-125 кДа. (+) – (норма): эпителий бронхов, нейроны центральной нервной системы. (+) – (патология): некоторые изоформы являются онкогенами и экспрессируются клетками рака груди.
CD169
SIGLEC1 (Sialic acid binding Ig-like Lectin 1). Сиалоадгезин (OMIM 600751; 20p13). Молекулярная масса 180 кДа. Трансмембранный иммуноглобулиноподобный лектин 1, связывающий сиаловую кислоту. (+) – макрофаги (кроме клеток микроглии), в том числе при ревматоидном артрите, атеросклерозе.
CD170
SIGLEC5 (Sialic acid binding Ig-like Lectin 5) (19q13.3). Иммуноглобулиноподобный лектин 5, связывающий сиаловую кислоту. Гомодимер с молекулярной массой 67 кДа, участвует в процессах межклеточных взаимодействий. (+): нейтрофилы.
CD171
Трансмембранная молекула адгезии клеток L1 (Xq28). Принадлежит к суперсемейству иммуноглобулинов. Молекулярная масса 180-200 кДа. Связывает CD171 (гомофильная адгезия), CD9, CD24, CD56, CD51/ CD61, CD29/CD49e, ламинин и др. (+) – (норма): постмитотические нейроны, глиоциты, некоторые эпителиальные клетки, CD4+ (но не CD8+) T-лимфоциты, моноциты, ДК, некоторые B-лимфоциты.
CD172a
SIRPa (Signal-Regulatory Protein a). Сигнальный регуляторный белок a (20p30). Трансмембранный гликопротеин суперсемейства иммуноглобулинов; субстрат для связанных с рецептором активированных тирозинкиназ. Участвует в процессах межклеточной адгезии и в ответе клеток на факторы роста. Лиганд для CD47. (+) – моноциты, некоторые T-клетки.
CD173
Антиген группы крови H2 – маркёр ранних гемопоэтических клеток. (+) – (норма): CD34+ гемопоэтические предшественники. (-) – зрелые лимфоциты.
Антиген группы крови Y Льюис (Lewis – LeY; 19q13.3). Дифукозилированный олигосахарид типа 2 – маркёр раннего гемопоэза. (+) – (норма): гемопоэтические предшественники фенотипа CD34+. (-) – зрелые лимфоциты.
CD175
Tn. Антиген ранних этапов синтеза муцина.
• CD175s (STN).
(+) – (патология): карциномы.
CD176
Томсена-Фридренрайха онкофетальный групповой антиген. Выявляют при колоректальной карциноме и колитах.
CD177
NB1, HNA2A. Антиген нейтрофилов специфический 1 (OMIM 162860). (+) – (норма): миелоидные клетки.
CD178
FasL. Fas-лиганд (CD95L) для рецептора CD95 (Fas/APO-1) (OMIM 134638; 1q23). Принадлежит к суперсемейству фактора некроза опухоли. Молекулярная масса 38-42 кДа. Взаимодействие CD178 (CD95L) c CD95 приводит к развитию апоптоза. (+) – (норма): активированные хелперные и цитотоксические T-клетки, NK-клетки, нейтрофилы, зрелые эритробласты, клетки Сертоли, нейроны, эпителиальные клетки щитовидной железы, яички, передняя камера глаза, плацента. (+) – (патология): клетки Рид-Штернберга.
CD179
• CD179a (VpreBI) – полипептид суперсемейства иммуноглобулинов (22q11.22). Молекулярная масса 16-18 кДа. В результате нековалентного связывания с CD179b формирует суррогатную лёгкую цепь преB-клеточного рецептора. (+) – (норма): про-B- и пре-B-клетки.
• CD179b (λ-5) – полипептид суперсемейства иммуноглобулинов (22q11.23). Молекулярная масса 22 кДа. (+) – (норма): про-B- и пре-B-клетки.
CD180
RP105 – трансмембранный белок с коротким цитоплазматическим регионом (5q12). Молекулярная масса 95-105 кДа. Внеклеточный регион белка формирует с молекулой MD-1 рецепторный комплекс RP105/
MD-1, относящийся к семейству Toll-подобных рецепторов (TLR – Toll-Like Receptors). (+) – (норма): B-клетки мантии и краевой зоны, B-клетки зародышевых центров (слабо), моноциты, ДК.
CD181
Ранее был известен как CDw128a. α-Цепь рецептора для ИЛ-8; рецептор типа 1 для хемокинов СХС (CXCR1 – Chemokine C-X-C receptor 1) (2q35). Связанный с G-белком гликопротеин, относящийся к семейству родопсинов. Молекулярная масса 58-67 кДа. (+) – (норма): нейтрофильные лейкоциты, моноциты, NK-клетки, некоторые T-лимфоциты, ДК, базофилы, кератиноциты.
CD182
Ранее был известен как CDw128b. β-Цепь рецептора ИЛ-8, рецептор типа 2 для хемокинов СХС (CXCR2) (2q35). Связанный с G-белком гликопротеин, относящийся к семейству родопсиноподобных рецепторов. (+) – (норма): нейтрофильные лейкоциты, моноциты, ДК, NK-клетки, зрелые гранулоциты, проекционные нейроны, нейроэндокринные клетки. (+) – (патология): карциноиды, аденомы гипофиза, феохромоцитомы, медуллярные карциномы.
CD183
GRP9. Трансмембранный рецептор CXCR3 для хемокинов семейства CXC (OMIM 600894). Молекулярная масса 40,6 кДа. Связывается с индуцированными интерфероном хемокинами СХCL9 (монокин MIG), CXCL10 (IP-10), CXCL11 (T-клеточный α-хемоаттрактант I-TAC). Обеспечивает хемотаксическую миграцию клеток. (+) – (норма): активированные T-эффекторы, клетки памяти (CD4+, CD8+), T-клетки при воспалении, эозинофилы, плазмоцитоидные ДК. (-) – наивные T-клетки.
CD184
Рецептор CXCR4 для хемокинов семейства CXC (2q21). Молекулярная масса 46-52 кДа. Опосредует хемотаксис клеток в ответ на связывание хемокина CXCL12 (SDF1α и SDF1β – Stromal cell-Derived Factor 1). Корецептор для ВИЧ. (+) – (норма): все зрелые клетки крови, эндотелиальные и эпителиальные клетки, астроциты, нейроны.
CD185
Рецептор CXCR5 для хемоаттрактанта В-лимфоцитов BLC (B Lymphocyte Chemoattractant) (11q23.3). Молекулярная масса 45 кДа. Экспрессирован на зрелых В-клетках и клетках лимфомы Беркитта.
Рецептор CXCR6 для хемокина CXCL16 (3p21). Молекулярная масса 40 кДа. Корецептор для ВИЧ. Экспрессирован на активированных Т-лимфоцитах.
CD191
MIP-1αR, RANTES-R. Рецептор CCR1 для хемокинов семейства CC (3p21). Молекулярная масса 39 кДа. Экспрессирован на Т-лимфоцитах, моноцитах, некоторых стволовых клетках.
CD192
MCP-1-R. Рецептор CCR2 для хемокинов семейства CC – MCP-1, MCP-3 и MCP-4 (3p21). Молекулярная масса 40 кДа. Корецептор с CD4 для ВИЧ. Экспрессирован на активированных NK-клетках и мононуклеарных фагоцитах, на некоторых Т-клетках, В-лимфоцитах, эндотелиальных клетках.
CD193
Рецептор CCR3 для хемокинов семейства CC – эотаксина, MCP-1, MCP-3, MCP-4, RANTES, MIP-1δ (3p21.3). Молекулярная масса 45 кДа. Корецептор с CD4 для ВИЧ. Экспрессирован на эозинофилах, моноцитах, некоторых Т-лимфоцитах.
CD194
Рецептор CCR4 для хемокинов семейства CC – эотаксина, MCP-1, CCL17/TARC, RANTES, MIP-1 (3p22.3). Молекулярная масса 41 кДа. Экспрессирован на тромбоцитах, моноцитах, некоторых Т-лимфоцитах.
CD195
Трансмембранный рецептор CCR5 для хемокинов семейства СС (3р21). Молекулярная масса 40 кДа. Участвует в процессах хемотаксиса T-лимфоцитов (чаще Th1), моноцитов, ДК, связывая хемокины CCL3 (MIP-1α – Macrophage Inflammatory Protein 1α – макрофагальный воспалительный белок 1α), CCL4 (MIP-1β – Macrophage Inflammatory Protein 1β– макрофагальный воспалительный белок 1β), CCL5 (RANTES – Regulated on Activation, Normal T cell Expressed and Secreted chemokine – хемокин, экспрессируемый и секретируемый нормальными T-клетками и регулируемый процессами активации).
CD196
Рецептор CCR6 для хемокинов семейства СС. Связывается с MIP3a/LARC и последовательно проводит сигнал, повышая внутриклеточ-
ный уровень ионов кальция. (+) – (норма): селезёнка, лимфатические узлы, аппендикс, фетальная печень. Экспрессируется на лимфоцитах, Т- и В-клетках, но не на NK-клетках, моноцитах и гранулоцитах.
CD197
Рецептор CCR7 для хемокинов семейства СС (17q12-q21.2). Молекулярная масса 46-52 кДа. Связывает хемокины CCL19 (MIP3β- Macrophage Inflammatory Protein 3β – макрофагальный воспалительный белок 3β) и CCL21 (SLC – Secondary Lymphoid tissue Chemokine – хемокин вторичной лимфоидной ткани). (+) – (норма): активированные B-клетки, T-лимфоциты, NK-клетки, ДК. (+) – (патология): ген CD197 индуцируется вирусом Эпштейна-Барр, рецептор опосредует действие вируса на B-клетки.
CDw198
Рецептор CCR8 для хемокинов семейства СС (3p22). Молекулярная масса 50 кДа. Корецептор c СD4 для ВИЧ. Экспрессирован на Т-лимфоцитах (особенно Th2), моноцитах, NK-клетках.
CDw199
Рецептор CCR9 для хемокинов семейства СС (3p21.3). Молекулярная масса 43 кДа. Связывает TECK. Корецептор c СD4 для ВИЧ. Экспрессирован на Т-лимфоцитах памяти, мононуклеарных клетках lamina propria.
CD200
OX-2, MOX2, OX2. Мембранный гликопротеин (OMIM 155970; 3q12q13). Член суперсемейства иммуноглобулинов. (+) – (норма): ФДК, тимоциты, B-клетки, T-клетки, нейроны, почка, эндотелий.
• CD200R (OX2R) – рецептор для CD200 (OMIM 607546).
CD201
EPCR (Endothelial protein C receptor). Рецептор для белка С эндотелия (20q11.2). Содержит домены α1 и α2 молекул MHC-I. Относится к семейству CD1/MHC-I – MHC-подобных гликопротеинов класса I, включающих CD1.
CD202b
Tie2, Tek. Рецептор для ангиопоэтиновых лигандов, связанный с тирозинкиназами (9р21). Молекулярная масса 145 кДа. Участвует в образовании и функционировании эндотелия сосудов. (+) – (норма): эндотелий, ранние гемопоэтические клетки.
CD203c
E-NPP3/PDNP3. Трансмембранный белок (6q22). Молекулярная масса 270 кДа. Принадлежит к семейству эктонуклеотидпирофосфатаз/ фосфодиэстераз. Участвует в процессах расщепления внеклеточных нуклеотидов, катализирует распад фосфодиэфирных и фосфосульфатных связей в дезоксинуклеотидах, никотинамиддинуклеотидах и нуклеотидных сахарах. (+) – (норма): простата, матка, базофилы, тучные клетки, миелоидные клетки. (+) – (патология): глиомы.
CD204
MSR1 (Macrophage Scavenger Receptor 1). Макрофагальный рецептор«мусорщик» 1 (8р22). Молекулярная масса 220 кДа. Обеспечивает связывание, поглощение и фрагментацию многих отрицательно заряженных макромолекул. (+) – (норма): миелоидные клетки.
CD205
DEC-205. Лимфоцитарный антиген 75 (LY75 – Lymphocyte antigen 75) (2q24). Рецептор ДК для связывания и поглощения антигена. (+) – (норма): ДК.
CD206
MMR. Рецептор макрофагов для маннозы – мембранный гликопротеин семейства лектинов типа С (10р13). Молекулярная масса 162 кДа. Связывает структуры, содержащие маннозу, на поверхности бактерий, вирусов, грибов. (+) – (норма): макрофаги, ДК.
CD207
LANGERIN (Langerhans cell specific C-type lectin). Специфический лектин типа С клеток Лангерганса (2р13). Молекулярная масса 40 кДа. (+) – (норма): клетки Лангерганса.
CD208
DC-LAMP (Dendritic Cell-specific Lysosomal-Associated Membrane Protein). Связанный с лизосомами мембранный белок, специфичный для
ДК (3q26.3-q27). (+) – (норма): ДК.
CD209
DC-SIGN (Dendritic Cell-Specific ICAM3-Grabbing Nonintegrin). Специфичный для ДК неинтегрин, связывающий ICAM3 (OMIM 604672).
(+) – (норма): ДК.
• CD209L (LSIGN, DCSIGNR) – лиганд для CD209
(OMIM 605872).
CDw210
Рецептор для ИЛ-10.
• CD210a – субъединица α рецептора (IL10Rα, IL10R1) (1q23).
• CDw210b – субъединица β рецептора (IL10Rβ, IL10R2) (21q22.11). Обе субъединицы относятся к семейству рецепторов для интерферона. Их совместная экспрессия обеспечивает трансдукцию сигнала, индуцируемого взаимодействием лиганд-рецептор. (+) – (норма): моноциты, B-клетки, T-клетки, естественные киллеры, селезёнка, тимус, плацента, лёгкое, печень.
CD212
Субъединица β1 рецептора ИЛ-12. Трансмембранный белок типа I. Принадлежит к суперсемейству рецепторов для цитокинов (гемопоэтинов). (+) – (норма): T-клетки, NK-клетки.
CD213
Рецептор ИЛ-13 (цепи α1 и α2).
• CD213a1. Цепь α1 рецептора ИЛ-13 (Xq24). Трансмембранный белок с молекулярной массой 65 кДа. Принадлежит к суперсемейству иммуноглобулинов. (+) – (норма): экспрессируется повсеместно, включая эндотелий, T- и B-клетки.
• CD213a2. Цепь α2 рецептора ИЛ-13 (Xq13.1-q28). Растворимая форма цепи подавляет связывание ИЛ-13 с рецептором. (+) – (норма): плацента.
CD217
Рецептор ИЛ-17 (22q11.1). Мембранный гликопротеин. Участвует в активации T-лимфоцитов и в индукции выработки ИЛ-2.
CD218
Рецептор ИЛ-18 (цепи α и β). Принадлежит к семейству рецепторов к ИЛ-1.
• CD218a IL18Rα (цепь α рецептора ИЛ-18) (2q12). Трансмембранный белок с молекулярной массой 70 кДа. Непосредственно связывает ИЛ-17.
• CD218b IL18Rβ (цепь β рецептора ИЛ-18) (2p24.3-2p24.1). Трансмембранный белок с молекулярной массой 70 кДа. Образует гетеродимер с α-цепью, усиливая связывание рецептора с ИЛ-17.
Экспрессия: T-клетки, NK-клетки, ДК.
INSR (Insulin Receptor). Рецептор для инсулина (19p13.3-p13.2). Трансмембранный гликопротеин. Состоит из двух α- и двух β-цепей. После аутофосфорилирования проявляет собственную тирозинкиназную активность. Экспрессия: гепатоциты, скелетная мышца, адипоциты, клетки плаценты, активированные T- и B-лимфоциты, моноциты, эритроциты.
CD221
IGF1R (Insulin-like Growth Factor 1 Receptor). Рецептор для инсулиноподобного фактора роста 1 (15q25-q26). Проявляет тирозинкиназную активность и обладает антиапоптогенными свойствами. Состоит из двух цепей – α (135 кДа) и β (90 кДа). Экспрессируется на многих клетках и на большинстве опухолей.
CD222
IGF2R (Insulin-like Growth Factor 2 Receptor). Рецептор для инсулиноподобного фактора роста 2 (6q26). Молекулярная масса 250 кДа. Полифункциональный трансмембранный лектин. Имеет короткий цитоплазматический фрагмент с участком, проявляющим способность перемещать лиганды внутрь клетки. Характеризуется как рецептор лизосомных гидролаз. Экспрессируется на многих клетках.
CD223
LAG3 (Lymphocyte Activation Gene 3) – ген активации лимфоцитов 3 (OMIM 153337; 12q13.3). Экспрессируется только на активированных T- и NK-клетках. Активирует моноциты и ДК, взаимодействуя с их молекулами главного комплекса гистосовместимости класса II.
CD224
γ-Глутамилтрансфераза (22q11.1-q11.2) – трансмембранный эктофермент, состоящий из двух нековалентно связанных полипептидных цепей – тяжёлой (62-68 кДа) и лёгкой (22 кДа). (+) – (норма): часть Tи B-лимфоцитов, эпителий сосудов, поджелудочная железа, почечные канальцы, семенники.
CD225
Leu13. Трансмембранный белок адгезии. Индуцируемый интерфероном трансмембранный рецептор, участвующий в контроле клеточного цикла. Способен передавать сигнал внутрь клетки. (+) – (норма): лейкоциты, эндотелий.
DNAM-1, PTA1. Гликопротеин с адгезивными свойствами (18q22.3). Молекулярная масса 65 кДа. Принадлежит к суперсемейству иммуноглобулинов. (+) – (норма): NK-клетки, тромбоциты, моноциты, некоторые B- и T-клетки.
CD227
MUC.1. Эписиалин. Трансмембранный муциновый гликопротеин c большим внеклеточным фрагментом и тандемными повторами из 20 аминокислот. Цитоплазматический фрагмент лишён киназной активности, но участвует в передаче сигнала. Лиганды: CD54, CD169, селектины и др. (+) – (норма): железистые эпителиальные клетки, гемопоэтические клетки (включая активированные), T- и некоторые B-лимфоциты, моноциты, клетки периневрия, ФДК. (+) – (патология): аденокарциномы, анапластические лимфомы, эпителиоидная саркома, менингиома, мезотелиома, миелома, плазмоцитома. (-) – карцинома печени и надпочечника.
CD228
Меланотрансферрин (3q28-q29). Поверхностный гликопротеин клеток меланомы. Существует в двух изоформах. Принадлежит к семейству трансферринов. Экспрессирован также на стволовых клетках.
CD229
Ly-9. Поверхностный антиген T- и В-лимфоцитов (OMIM 600684; 1q21.3-q22). Член суперсемейства иммуноглобулинов.
CD230
Прионовый белок. Экспрессируется на многих клетках.
CD231
TALLA-1. Антиген T-клеточного острого лимфолейкоза (Xq11.4). Мембранный гликопротеин семейства тетраспанинов. Молекулярная масса 150 кДа. (+) – (норма): нейроны. (+) – (патология): T-клеточный острый лимфолейкоз, нейробластома. (-) – В-клетки, моноциты.
CD232
Плексин C1 (PLXNC1) (12q233). Молекулярная масса 200 кДа. Рецептор для семафоринов, кодируемых генами вирусов. Экспрессируется на многих клетках.
Гликопротеин плазматической мембраны эритроцитов (17q21-q22). Молекулярная масса 93-110 кДа. Относится к антигенам группы крови Diego (D1). Через интегральный домен обеспечивает транспорт через мембрану (обмен 1:1) неорганических анионов. Через цитоплазматический домен связан с белками цитоскелета, гемоглобином и белками гликолиза. Сохраняет механические свойства и интегрированность эритроцитов.
CD234
Гликопротеин Fy (1q21-q22). Антиген группы крови Duffy. Рецептор эритроцитов для многих хемокинов (ИЛ-8, RANTES, MCP-1, GRO, TARC), а также для Plasmodium vivax и P. knowlesi. Молекулярная масса 35 кДа. (+) – эритроциты; эндотелий посткапиллярных венул, синусоидов селезёнки и костного мозга; клетки Пуркинье мозжечка, эпителий почки и лёгочных альвеол.
CD235
Гликофорины. (+) – (норма): эритроидные клетки.
• CD235a (гликофорин А). Несёт детерминанты антигенов групп крови MN и Ss. N-концевой сегмент служит рецептором для вируса гриппа.
• CD235b (гликофорин B). Несёт детерминанты антигенов группы крови Ss).
• CD235ab (гликофорин A/B).
CD236
Гликофорин C/D. (+) – эритроидные клетки.
CD236R (гликофорин C). Антиген группы крови Gerbich. Регулирует механическую стабильность эритроцитов. При мутациях кодирующего гена возникают гликофорины D, известные как антигены групп крови Gerbich и Duch. (+) – эритроидные клетки, некоторые стволовые клетки.
CD238
Антиген группы крови Kell(7q33).Трансмембранный гликопротеин. (+) – (норма): эритроидные клетки, некоторые стволовые клетки.
CD239
B-CAM. B-клеточная молекула адгезии (19q13.2). Антиген группы крови Lutheran. Антиген b группы крови Auberger. Гликопротеин супер-
семейства иммуноглобулинов. (+) – (норма): эритроидные клетки, некоторые стволовые клетки.
CD240CE
Антигены Rh – Cc и Ee. (+) – (норма): эритроидные клетки.
CD240D
Антиген Rh D. (+) – (норма): эритроидные клетки.
CD240DCE
Антиген Rh. Выявляется моноклональными антителами Rh30D/CE. (+) – (норма): эритроидные клетки.
CD241
Антиген Rh (6p21.1-p11). Участвует в процессах транспорта аммония. Является частью макромолекулярных комплексов с CD48, а также антигенов группы крови Ландштейнера-Винера (Landsteiner-Wiener) и гликофорина B. (+) – (норма): эритроидные клетки.
CD242
ICAM-4 (Intercellular Adhesion Molecule 4) – молекула межклеточной адгезии 4. Антиген группы крови Ландштейнера-Винера (Landsteiner- Wiener) – LW. Принадлежит к суперсемейству иммуноглобулинов. Взаимодействует с интегрином LFA-1. (+) – (норма): эритроидные клетки.
CD243
MDR-1. П-гликопротеин типа 1 (7q21.1). Член семейства белковтранспортёров ABC (ATP-Binding Cassette – АТФ-связывающих), осуществляющих транспорт различных веществ через наружные и внутренние мембраны клеток. В норме MDR-1 также транспортирует вещества через гематоэнцефалический барьер. В раковых клетках выполняет функцию насоса, выводящего из клеток химиотерапевтические препараты, приводя к снижению их токсичности. Отвечает за развитие множественной лекарственной устойчивости (MDR – MultiDrug Resistance). (+) – (норма): кора надпочечников, жёлчные канальцы; эндотелий капилляров мозга; яички, плацента, пищеварительный тракт, стволовые клетки.
CD244
2B4. Активационный рецептор NK-клеток (OMIM 605554; 1q22). Молекулярная масса 70 кДа. Относится к мембранным гликопротеинам подсемейства CD2 и входит в состав суперсемейства иммуноглобулинов. Функционирует как корецептор активирующего рецептора
NK-клеток NKp46. Участвует в цитолитических реакциях NK-клеток. С высокой степенью аффинности связывается с CD48. Экспрессируется на всех NK-лимфоцитах и у5Т-лимфоцитах, моноцитах, базофилах, на CD8+ T-клетках (50%) и на CD4+ T-лимфоцитах (0,5-5%). На B-клетках отсутствует.
CD245
p220/240. Рецептор лимфоцитов. Экспрессируется на части Т-клеток.
CD246
Киназа анапластической лимфомы (Alk, Alk-1 – Anaplastic lymphoma kinase) (2p23). Протеинтирозинкиназный рецептор с внеклеточным и трансмембранным доменами. Играет значимую роль в развитии мозга, влияет на специфические нейроны центральной нервной системы. Сходен с киназами суперсемейства рецепторов для инсулина. (+) – (норма): кишечник, T-клетки.
CD247
Также известный как CD3Z (Z) (OMIM 186780; 1q22-q23). Полипептидная цепь дзета – ζ. Молекулярная масса 12 кДа. В виде гомодимера формирует совместно с цепями δ, γ и ε CD3 внутриклеточную область комплекса молекул TCR. Каждая из ζ-цепей содержит по 3 домена ITAM c функцией проведения сигнала, инициированного взаимодействием лиганд-рецептор. (+) – (норма): αβT-клетки или γδT-клетки.
CD248
TEM1. Эндосиалин (Endosialin). Молекулярная масса 175 кДа. Поверхностный эндосиалин. Экспрессируется преимущественно фибробластами и субпопуляцией перицитов (малодифференцированные соединительнотканные клетки, примыкающие к наружной поверхности капилляра), ассоциированных с сосудами. Внутриклеточный маркёр эпителиальных опухолей, но не нормального эндотелия. Локализуется совместно с тромбомодулином (CD141) и, возможно, играет роль в ангиогенезе опухолей.
CD249
Глютамиламинопептидаза (аминопептидаза А), ассоциированная с мембраной. Металлопептидаза. Деградирует биоактивные пептиды, включая ангиотензин II. Молекулярная масса 160 кДа. Экспрессия возрастает на клетках карциномы под влиянием сосудистого эндотелиаль-
ного ростового фактора (VEGF) и при взаимодействии между клетками опухоли и стромы (фибробластами).
CD252
TNFSF4 [Tumor Necrosis Factor (ligand) Superfamily, member 4]. Молекулярная масса 34 кДа. Цитокин семейства лигандов фактора некроза опухоли. Служит лигандом рецептора TNFRSF4. Участвует во взаимодействии между Т-лимфоцитами и АПК, В-клетками, NK-лимфоцитами, тучными клетками. Опосредует адгезию активированных Т-клеток к эндотелию сосудов. CD252 селективно индуцирует Th2-тип иммунного ответа, повышая выработку CD4+ Т-клетками ИЛ-4, ИЛ-5 и ИЛ-13. Полиморфизм TNFSF4 повышает риск развития атеросклероза.
CD253
TRAIL (Tumor Necrosis Factor-Related Apoptosis Inducing Ligand). TNFSF10 [Tumor Necrosis Factor (ligand) SuperFamily, member 10]. Молекулярная масса 33-34 кДа. Цитокин семейства лигандов фактора некроза опухоли. Связывается с некоторыми членами суперсемейства рецепторов фактора некроза опухоли. Участвует в регуляции активации Т-клеток человека. CD253 играет важную роль в апоптозе клеток эпителия желудка под влиянием Helicobacter pylori. Индуцирует апоптоз преимущественно в трансформированных и опухолевых клетках, хотя активно экспрессируется клетками большинства нормальных тканей. (+) – (патология): выявляют в поражённых участках мозга больных болезнью Альцгеймера.
CD254
TNFSF11 [Tumor Necrosis Factor (ligand) SuperFamily, member 11]. Молекулярная масса 35 кДа. Член цитокинового семейства лигандов фактора некроза опухоли – лиганд остеопротегерина (фактор развития и активации остеокластов). Важен для остеокластогенеза. Один из факторов выживаемости ДК при их взаимодействии с Т-лимфоцитами в очаге воспаления. Может опосредовать связь между сосудистой, скелетной и иммунной системами. Играет центральную роль в регуляции кальцификации сосудов. Экспрессия CD254 повышена при периодонтите.
CD255
TWEAK. TNFSF12 [Tumor Necrosis Factor (ligand) SuperFamily, member 12]. Молекулярная масса 18 кДа. Член цитокинового семейства лигандов фактора некроза опухоли – лиганд TWEAKR (CD266). Существует в мембраносвязанной и растворимой формах. Экспрессируется
моноцитами, эндотелиальными клетками и лимфоцитами при стимуляции ИФНу.
CD256
APRIL. TNFSF13 [Tumor Necrosis Factor (ligand) SuperFamily, member 13]. Молекулярная масса 16 кДа. Член семейства лигандов фактора некроза опухоли. Служит лигандом для TNFRSF17 – члена семейства рецепторов фактора некроза опухоли. Важен для развития В-клеток. Уровни растворимых CD256 и CD257 молекул повышены в сыворотке при синдроме Шегрена и при множественной миеломе, а уровень CD256 – при хроническом В-клеточном лимфолейкозе. В основном CD256 и CD257 вырабатываются моноцитами и нейтрофилами в костном мозге. Гепарин-сульфат протеогликан служит рецептором CD256. CD256 способствует физиологической выработке тромбоцитов.
CD257
TNFSF13B [Tumor Necrosis Factor (ligand) SuperFamily, member 13b]. Молекулярная масса 45 кДа. Синонимы – BAFF и BLyS (B-cell Activating Factor – В-клеточный активирующий фактор). Цитокин семейства лигандов фактора некроза опухоли. Служит лигандом рецепторов TNFRF13B, TNFRF17 и TNFSF13C. Экспрессируется на Т-лимфоцитах, макрофагах, ДК. Существует также в секретируемой форме. Аутокринно секретируется активированными В-клетками и действует как сильный активатор их развития. Вместе с CD256 поддерживают выживаемость лейкозных В-клеток. Защищает В-клетки от апоптоза в условиях воспаления. Уровень растворимого CD257 повышен при системной красной волчанке, ревматоидном артрите, синдроме Шегрена, множественной миеломе. Играет роль во взаимодействии между моноцитами (продуцентами CD257) и В-лимфоцитами при некоторых аутоиммунных заболеваниях.
CD258
TNFSF14 [Tumor Necrosis Factor (ligand) SuperFamily, member 14]. Молекулярная масса 28 кДа. Цитокин семейства лигандов фактора некроза опухоли. Служит лигандом для TNFRSF14 и рецептора лимфотоксина β. Трансмембранный белок типа II. Имеет 30% идентичность с FasL и лимфотоксином β. Экспрессируется на активированных лимфоцитах и незрелых ДК, способствуя их созреванию. Стимулирует пролиферацию Т-клеток и запускает апоптоз различных опухолевых клеток. CD258 опосредует взаимодействие между Т-клетками и АПК. Присутствует на
NK-клетках и Т-лимфоцитах кишечника и играет роль в регуляции иммунных процессов на слизистых оболочках.
CD261
TNFRSF10A (Tumor Necrosis Factor Receptor SuperFamily, member 10a). Молекулярная масса 57 кДа. Белок суперсемейства рецепторов фактора некроза опухоли, ответственный за передачу «сигнала смерти». Активируется под влиянием лиганда TNFSF10/TRAIL. Этот цитотоксический лиганд принадлежит к семейству фактора некроза опухоли и индуцирует апоптоз в клетках-мишенях. Запуск апоптоза реализуется с участием дополнительного цитоплазматического адапторного белка, содержащего домен смерти (FADD – Fas-Associated Death Domain). CD261 широко распространён на опухолевых (клетки саркомы желудка) и нормальных клетках, включая тимоциты человека, миелоидные предшественники, нейроны, астроциты, олигодендроциты. Полиморфизм CD261 ассоциируется с риском развития рака мочевого пузыря.
CD262
TNFRSF10B (Tumor Necrosis Factor Receptor SuperFamily, member 10b). Белок суперсемейства рецепторов фактора некроза опухоли. Содержит внутриклеточный домен смерти. Молекулярная масса 60 кДа. CD262 активируется через лиганд TNFSF10. CD262 широко представлен на нормальных и опухолевых клетках. Выявлен на тимоцитах человека, на клетках HepG2, инфицированных вирусом Денге 2. CD261 и CD262 отличаются по используемым факторам трансдукции сигнала и силе индукции апоптоза опухолевых клеток. Синовиальные клетки больных ревматоидным артритом экспрессируют высокий уровень CD262 и высоко чувствительны к апоптозу, индуцированному через CD262. При холестазе в печени возрастает экспрессия мРНК и белка CD262.
CD263
TNFRSF10C (Tumor Necrosis Factor Receptor Superfamily, member 10c). Молекулярная масса 65 кДа. Белок суперсемейства рецепторов фактора некроза опухоли. Заякорен в мембране через гликофосфатидилинозитовый хвост. Апоптоз не запускает, но играет роль антагонистического рецептора, защищающего клетки от апоптоза. CD263 присутствует на клетках многих нормальных тканей и большинства опухолевых линий.
CD264
TNFRSF10D (Tumor Necrosis Factor Receptor SuperFamily, member 10d). Молекулярная масса 35 кДа. Белок суперсемейства рецепторов факто-
ра некроза опухоли. Содержит усечённый нефункционирующий цитоплазматический домен смерти. Рецептор не запускает апоптоз и играет роль ингибитора апоптоза. На клетках периферической крови здоровых людей экспрессируются разные рецепторы анализируемой серии: TRAILR1 – В-лимфоциты, TRAILR2 – моноциты, TRAILR3 – нейтрофилы. (+) – CD8+ Т- и NKT-лимфоциты. (-) – CD4+ Т-клетки.
CD265
TNFRSF11A (Tumor Necrosis Factor Receptor SuperFamily, member 11a). Молекулярная масса 97 кДа. Белок суперсемейства рецепторов фактора некроза опухоли. Может взаимодействовать с разными белками TRAF семейства и активировать NF-kB (NF-kB-активатор) и MAPK8/JNK киназы. Участвует в кооперации Т-лимфоцитов и ДК в процессе воспаления. CD265 может играть ключевую роль в регуляции кальцификации сосудов и быть связан с возрастным снижением минерализации, остеопорозом, атеросклерозом и различными метаболическими патологиями. (+) – соматические и гемопоэтические клетки (макрофаги, ДК и другие клетки).
CD266
TNFRSF12A (Tumor Necrosis Factor Receptor SuperFamily, member 12a). Трансмембранный белок типа I. Член суперсемейства рецепторов фактора некроза опухоли. Молекулярная масса 14 кДа. Активирует NF-kB, индуцирует экспрессию антиапоптозных белков BCL-XL и ВCL-W. Участвует в запуске апоптоза некоторых опухолевых клеток, а также может отвечать за индукцию пролиферации клеток эндотелия и ангиогенез. (+) – клетки глиомы, влияет на клеточную устойчивость к цитотоксической терапии, вызывающей апоптоз. CD266 постоянно экспрессируется на культивируемых фибробластах человека, которые в ответ на связывание лиганда TNFSF12/TWEAK вырабатывают хемокин RANTES.
CD267
TNFRSF13B (Tumor Necrosis Factor Receptor SuperFamily, member 13b). Молекулярная масса 32 кДа. Специфичный для лимфоцитов член суперсемейства рецепторов фактора некроза опухоли. Лиганд – CAML (Calcium-Modulator and cyclophilin Ligand) через CD267 вызывает активацию факторов транскрипции NFAT, AP-1 и NF-kB и играет важную роль в гуморальном иммунитете.
CD268
BAFFR. TNFRSF13C (Tumor Necrosis Factor Receptor SuperFamily, member 13c). Молекулярная масса 25 кДа. Трансмембранный белок типа III
суперсемейства рецепторов фактора некроза опухоли, содержащий один внеклеточный домен, обогащённый цистеином. Главный рецептор, необходимый для выживаемости нормальных зрелых В-лимфоцитов и регуляции периферической популяции В-клеток. Поддерживает рост и выживаемость клеток множественной миеломы. Через CD268 регулируется выживаемость и созревание В-клеток при системной красной волчанке.
CD269
TNFRSF17 (Tumor Necrosis Factor Receptor SuperFamily, member 17). Молекулярная масса 27 кДа. Важный регулятор функции В-клеток. Во внеклеточном участке рецептор содержит полный или частичный домен, обогащённый цистеином. Белок суперсемейства рецепторов фактора некроза опухоли (рецептор для BAFF и APRIL). (+) – селективно экспрессируется зрелыми В-лимфоцитами и важен для их развития и аутоиммунного ответа. Присутствует на клетках множественной миеломы.
CD270
TNFRSF14 (Tumor Necrosis Factor Receptor SuperFamily, member 14). Молекулярная масса 30 кДа. Активатор лимфоцитов. Белок суперсемейства рецепторов фактора некроза опухоли (рецептор для BTLA, TNFSF14/LIGHT и лимфотоксина альфа). Экспрессируется разными популяциями лимфоцитов и лейкоцитов. Этот рецептор используется вирусом простого герпеса (HSV) для проникновения в активированные Т-лимфоциты.
CD271
NGFR (Nerve Growth Factor Receptor). Рецептор фактора роста нервов. Молекулярная масса 75 кДа. CD271 участвует в регуляции выживаемости, дифференцировки и миелинизации нейронов и, в зависимости от типа анализируемых клеток мишеней, индуцирует выживаемость или апоптоз. CD271 служит одним из наиболее специфических маркёров мезенхимальных стволовых клеток, происходящих из костного мозга. Может опосредовать клеточную гибель в разных моделях, включая нейроны гиппокампа. Обнаружен в пренатальном гипофизе человека. В развивающейся сетчатке глаза клеточная гибель происходит в результате взаимодействия фактора роста нервов с CD271. Это взаимодействие может играть роль в патогенезе дегенерации нервов при болезни Альцгеймера.
BTLA (B and T Lymphocyte Associated). Важный негативный регулятор активации Т-лимфоцитов и/или гомеостаза иммунного ответа. (+) – экспрессируется в процессе активации Т-клеток и сохраняется на Th1-клетках, а также на развивающихся Т- и В-клетках, всех зрелых лимфоцитах, селезёночных макрофагах, зрелых ДК костномозгового происхождения. (-) – Th2-клетки.
CD273
PDCD1LD2 (Programmed Cell Death 1 Ligand 2). Молекулярная масса 25 кДа. Негативный регулятор активации Т-клеток. Играет важную роль в уклонении опухоли от действия иммунной системы. Экспрессия CD273 может контролироваться на посттранскрипционном уровне через альтернативный сплайсинг. Модуляция изоформы CD273 может влиять на исход иммунного ответа. У человека экспрессия CD273 обратно коррелирует с уровнем CD8+ Т-клеток, инфильтрирующих рак пищевода.
CD274
B7-H1 или PD-L1 (см. CD273). Молекулярная масса 40 кДа. Регуляторная молекула, член семейства В7. Присутствует постоянно на моноцитах, макрофагах и ДК и индуцируется на активированных Т- и В-лимфоцитах, клетках эпителия и эндотелия. Белок суперсемейства иммуноглобулинов. Положительная регуляторная роль PD-L1 показана преимущественно in vitro и на экспериментальных моделях, тогда как отрицательная регуляторная роль показана при многих заболеваниях человека (рак, ревматоидный артрит, ВИЧ-инфекция). Может вовлекаться в иммунное отклонение при развитии ряда опухолей. Поверхностная экспрессия и количество мРНК PD-L1 и выработка ИЛ-10 возрастают при инфекции ВИЧ-1 и снижаются после высокоактивной противоретровирусной терапии.
CD275
B7-H2. ICOSLG (Inducible T cell Co-Stimulator Ligand). ICOSL (см. CD274). Молекулярная масса 60 кДа. Экспрессия функциональной молекулы ICOSL может привести к прогрессированию острого миелолейкоза. Костимуляция через ICOS-ICOSL может участвовать в отрицательной регуляции клеточного иммунного ответа и способствовать уклонению опухоли от иммунной системы. Взаимодействие ICOS- ICOSL играет роль в патогенезе волчаночного нефрита. CD275 экспрессируют клетки эпителия дыхательных путей. Возможно, эти молекулы
могут участвовать в презентации антигена эпителиальными клетками, а также в активации Т-клеток памяти.
CD276
B7-H3. Член семейства В7. Костимулятор молекул В7 (В7.1, или CD80), действующий через молекулы семейства CD28 (CD28, CTLA4 и ICOS). Молекулярная масса 40-45 кДа. (+) – представлен на моноцитах. Его экспрессию на ДК могут индуцировать провоспалительные цитокины. Растворимые молекулы B7-H3 человека соединяются с активированными Т-лимфоцитами и костимулируют их пролиферацию и выработку этими клетками преимущественно ИФНу. B7-H3 экспрессируют клетки назального эпителия. Они могут через этот рецептор взаимодействовать с активированными назальными Т-лимфоцитами.
CD277
BTN3A1 (Butyrophilin, subfamily 3, member A1). Член суперсемейства иммуноглобулинов. Молекулярная масса 56 кДа. Присутствует на лимфоцитах, моноцитах. Участвует в активации Т-лимфоцитов.
CD278
ICOS (Inducible T-cell Co-Stimulator). Белок семейства рецепторов CD28 и CTLA4. Молекулярная масса 56 кДа. Играет важную роль в межклеточной передаче сигналов, иммунном ответе и регуляции пролиферации клеток. Уровень ICOS повышается на Т-клетках человека после стимуляции с модуляцией выработки Th1- и Th2-цитокинов. Усиливает костимулирующий эффект в отношении Т-клеток памяти. Экспрессия ICOS на активированных Т-хелперах (преимущественно Th2) может усиливать эффекторный Т-клеточный ответ в периферических тканях. Взаимодействие ICOSL-ICOS активно усиливает выработку ИЛ-10. Локальный иммунный ответ может модулироваться под влиянием ICOS на Т-клетках в суставах больных ревматоидным артритом.
CD279
PD-1 (Programmed cell Death). Поверхностный мембранный белок суперсемейства иммуноглобулинов. Молекулярная масса 55 кДа. Участвует в индукции толерантности лимфоцитов. Взаимодействует с CD274. Экспрессируется на активированных Т- и В-лимфоцитах, миелоидных клетках. PD-1 выявляют на Т-лимфоцитах, а его лиганд PD-L1 – на клетках эпителия при воспалении слюнных желёз у больных синдромом Шегрена. Полиморфизм гена, кодирующего PD-1, ассоциируется с чувствительностью к ревматоидному артриту.
MRC2 (Mannose Receptor C type 22). Молекулярная масса 180 кДа. Семейство рецепторов маннозы включает: маннозный рецептор, рецептор М-типа фосфолипазы А2. CD280 не функционирует в качестве фагоцитарного рецептора in vitro. CD280 играет важную физиологическую роль в деградации и ремодулировании внеклеточного матрикса в процессе развития тканей и гомеостаза. Вызывая дисбаланс метаболизма коллагена, CD280 может участвовать в развитии патологических процессов, таких, как воспаление, фиброз и метастазирование опухоли.
CD281
TLR1 (Toll-Like Receptor 1). Молекулярная масса 90 кДа. Член семейства Toll-подобных рецепторов, играющих главную роль в распознавании патогенов и активации врождённого иммунитета. Реагирует с бактериальным липопротеином.
CD282
TLR2 (Toll-Like Receptor 22). Молекулярная масса 85 кДа. Член семейства Toll-подобных рецепторов. Реагирует с пептидогликаном. Экспрессируется, преимущественно, лейкоцитами периферической крови и опосредует ответ на грамположительные бактерии и грибы через стимуляцию NF-kB.
CD283
TLR3 (Toll-Like Receptor 3). Молекулярная масса 100 кДа. Член семейства Toll-подобных рецепторов. В большом количестве представлен в плаценте, поджелудочной железе и на миелоидных ДК. Распознаёт двуцепочечную РНК, ассоциированную с вирусной инфекцией. Вызывает активацию NF-kB и выработку провоспалительных цитокинов и интерферонов типа I. Может участвовать в противовирусной защите.
CD284
TLR4 (Toll-Like Receptor 4). Молекулярная масса 85 кДа. Член семейства Toll-подобных рецепторов. Экспрессируется преимущественно на клетках плаценты и незрелых миелоидных ДК. Связывает ЛПС, присутствующий у большинства грамотрицательных бактерий. Мутации гена обусловливают различия по отвечаемости на ЛПС.
CD286
TLR6 (Toll-Like Receptor 6). Член семейства Toll-подобных рецепторов. Функционально димеризуется с TLR2 для реализации клеточного ответа на бактериальные липопротеины.
TLR8 (Toll-Like Receptor 8). Член семейства Toll-подобных рецепторов. Экспрессируется преимущественно лейкоцитами лёгких и периферической крови. Взаимодействует с пареховирусом человека типа 1 и активирует сигналы, приводящие к выработке провоспалительных молекул.
CD289
TLR9 (Toll-Like Receptor 9). Молекулярная масса 115-120 кДа. Член семейства Toll-подобных рецепторов. Экспрессируется преимущественно в тканях, обогащённых иммунными клетками (селезёнка, лимфатические узлы, костный мозг), а также на лейкоцитах периферической крови. Лиганд – неметилированные CpG олигодинуклеотиды бактериальной ДНК. CpG стимулирует экспрессию TLR9 на В-клетках.
CD290
TLR10 (Toll-Like Receptor 10). Член семейства Toll-подобных рецепторов. N-гликозилированный белок. Высокоэкспрессирован на клетках в селезёнке, лимфатических узлах, тимусе, лёгких. Выявляют на В-клетках периферической крови, плазмоцитоидных ДК миндалин. Генетические варианты TLR10 связаны с риском развития бронхиальной астмы.
CD292
BMPR1A (Bone Morphogenetic Protein Receptor, type 1A). Молекулярная масса 50-58 кДа. Рецептор белка, участвующего в остеогенезе (ВМР). Принадлежит к семейству трансмембранных серин-треониновых киназ, включающих рецепторы типа I (BMPR1A и BMPR2A) и типа II (BMPR2). Тесно связаны с рецепторами активина (ACVR1 и ACVR2). Лигандами CD292 служат члены суперсемейства ТФРР. Поверхностная экспрессия и интернализации BMPR1A нарушены у больных прогрессирующей фиброзной остеодисплазией (болезнь Лихтейнштайна-Брайцева). У эмбрионов и взрослых людей CD292 высоко и специфически экспрессируется всеми клетками ганглиев нервной системы кишечника. Генетические мутации зародышевой линии в BMPR1A выявляют у некоторых больных юношеским полипозом и больных болезнью Коудена.
CDw293
BMPR1B (Bone Morphogenetic Protein Receptor, type 1B) (см. CD292). CDw293 член семейства трансмембранных серин-треониновых киназ. Молекулярная масса 50-58 кДа. Лиганды CDw293 – белки, участвующие в остеогенезе (BMP), входящие в суперсемейство фактора некроза
опухоли p. BMP вовлекаются в эндохондриальное образование кости и в эмбриогенез. Через BMPR1B опосредуется апоптоз остеобластных клеток, независимо от их дифференцировки. Мутации гена, кодирующего CDw293, ассоциированы с первичной лёгочной гипертензией.
CD294
GPR44 (G Protein-Coupled Receptor 44). Член семейства рецепторов, соединённых с белком G. Интегральный мембранный белок, содержащий 7 трансмембранных доменов. Молекулярная масса 55-70 кДа. CD294 в качестве хемоаттрактантного рецептора простагландина D2 опосредует его провоспалительное действие. Провоспалительные эффекты CD294 связаны с привлечением эозинофилов и Th2-клеток в очаг воспаления. Присутствует на базофилах, эозинофилах. Селективно экспрессируется на Th2-, но не Th1-лимфоцитах. При атопическом дерматите увеличивается количество CD4+ CD294+ Тh2-клеток. Характерна ассоциация генетических вариантов CD294 с бронхиальной астмой.
CD295
LEPR (Leptin Receptor). Молекулярная масса 130-150 кДа. Лиганд CD295 – гормон лептин, участвующий в контроле состояния сытости, расхода энергии, потребления пищи и ряда репродуктивных процессов. Лептин регулирует пролиферативную и антиапоптотическую активность многих типов клеток, включая Т-лимфоциты; стимулирует макрофаги и нейтрофилы в процессе воспаления. Через CD295 лептин замедляет апоптоз зрелых нейтрофилов in vitro. (+) – CD295 выявляют на поверхности клеток многих тканей: в мозге, плаценте, поджелудочной железе, надпочечниках, печени, сердце, лёгких, на гемопоэтических клетках, а также на опухолевых клетках (рак лёгких, желудка, эндометрия, молочной железы, на лейкозных клетках). Тромбоциты рассматривают как главный источник лептиновых рецепторов в циркуляции.
CD296
ART1 (ADP-RibosylTransferase 1). Молекулярная масса 37 кДа. АДФ-рибозилтрансфераза катализирует рибозилирование АДФ на остатке аргинина в белке. Аргининспецифические моно-АДФрибозилтрансферазы опосредуют модификацию белков на посттрансляционной стадии. ART1 локализуется на поверхности клеток многих тканей, включая лейкоциты, и прикреплён к мембране через GPI-якорь. CD296 участвует в контроле цитолитической активности, пролиферации и межклеточной адгезии ЦТЛ. На поверхности нейтрофилов человека ART1 участвует в реализации их каталитической активности.
ART4 (ADP-RibosylTransferase 4) антиген группы крови Dombrock. Моно-АДФ-рибозилтрансфераза типа 4 относится к семейству эктоферментов, катализирующих перенос АДФ-рибозы из NAD+ в намеченный белок. Молекулярная масса 38 кДа. Антиген группы крови Dombrock локализуется на генном продукте, заякоренном через GPI на мембране эритроцита. Аллельные варианты CD297 могут быть связаны с трансфузионными осложнениями.
CD298
ATP1B3 (ATPase, Na+/K+ transporting, Beta 3 polypeptide). Молекулярная масса 50-60 кДа. CD298 является одной из бета-субъединиц Na+/ K+ АТФазы, интегрального мембранного белка, ответственного за установление и поддержание электрохимического градиента ионов Na+ и К+, проникающих через плазматическую мембрану, что важно для электрической возбудимости нервов и мышц.
CD299
CLEC4M (C-type Lectin domain family 4 member M). Интегральный мембранный белок типа II на 77% идентичный CD209. Молекулярная масса 45 кДа. Участвует в распознавании разных гликопротеинов через лектиновый домен, опосредующий узнавание углеводов. CD299 выявляют в клетках слизистых оболочек влагалища и прямой кишки. CD299 рассматривают как кофактор в половом пути трансмиссии ВИЧ-1. Опосредует проникновение в клетки вируса Эбола.
CD300a
CMRF35H. Член суперсемейства иммуноглобулинов с одним V-подобным иммуноглобулиновым доменом. В цитоплазматическом домене содержит ITIM. Молекулярная масса 60 кДа. Обладает свойством иммунорегуляторных сигнальных молекул. Присутствует преимущественно на миелоидных клетках (моноциты, нейтрофилы), а также на некоторых Т- и В-клетках.
CD300c
CMRF35A. Лейкоцитарный иммуноглобулиноподобный рецептор. Так же как CD300a – член семейства иммунорегуляторных сигнальных молекул, играющих важную роль в регуляции иммунного ответа. Экспрессирован на моноцитах, нейтрофилах, некоторых Т- и В-лимфоцитах.
CD300e
CMRF35L1. Экспрессирован на моноцитах, макрофагах.
CD301
CLEC10A (C-type Lectin domain family 10, member A). Молекулярная масса 38 кДа. Член суперсемейства молекул с доменом, подобным лектину С-типа. Трансмембранный белок типа II функционирует как поверхностный клеточный антиген, в частности, на макрофагах. Участвует в адгезии, межклеточной передаче сигналов, в воспалительном и иммунном ответах. Может связывать Т-независимые антигены.
CD302
DCL-1. Трансмембранный лектин С-типа I. DCL-1 – необычный лектиновый рецептор, важный не только для эндоцитоза и фагоцитоза, но и для адгезии и миграции клеток. В качестве фузионного белка с DЕС-205 (CD205) экспрессируется на линиях клеток Березовского-Штенберга, имеющих многие характеристики АПК и связанных с развитием классической лимфомы Ходжкина. Молекулярная масса 30 кДа. В норме экспрессируется на моноцитах, макрофагах, гранулоцитах и ДК.
CD303
CLEC4C (C-type Lectin domain family 4, member C) (см. CD301). Молекулярная масса 38 кДа. Трансмембранный белок типа II может играть роль в реализации функций ДК (в частности, плазмоцитоидных ДК). Подавляет синтез ИФНα этими клетками.
CD304
NRP1 (NeuRoPilin 1 – нейронный рецептор). Молекулярная масса 140 кДа. Связанный с клеточной мембраной корецептор тирозинкиназного рецептора (VEGFR2) для членов семейств фактора роста сосудистого эндотелия (VEGF; мощный медиатор проницаемости эндотелия, хемотаксиса и пролиферации) и семафорина. Многофункциональный рецептор, участвующий в ангиогенезе, росте аксонов, а также выживаемости, миграции и инвазии клеток. Нейронный рецептор CD304 экспрессируется ДК и покоящимися Т-клетками человека. Высокий уровень CD304 на клетках многих опухолей усиливает ангиогенез. Сверхэкспрессия гена NRP1 коррелирует с плохим прогнозом глиомы человека.
CD305
LAIR-1 (Leukocyte-Associated Ig-like Receptor 1). Принадлежит к суперсемейству иммуноглобулинов и семейству ингибиторных рецепторов,
ассоциированных с лейкоцитами. Молекулярная масса 40 кДа. Особенность LAIR-1 – широкая представленность в иммунной системе и неспособность распознавать молекулы MHC-I. CD305 экспрессирован на большинстве периферических мононуклеарных клеток, включая NK-клетки, Т-лимфоциты, В-лимфоциты, моноциты, ДК, а также тимоциты. Плотность экспрессии CD305 непосредственно связана с подавлением функций Т-лимфоцитов человека, включая цитотоксичность, пролиферацию, выработку цитокинов. Хроническая с обострениями инфекция вирусом Эпштейна-Барр ассоциируется с низкой экспрессией LAIR-1 на NK-клетках.
CD306
LAIR-2 (Leukocyte-Associated Ig-like Receptor 2). Сходен с LAIR-1. Экспрессирован на мононуклеарных лейкоцитах и обладает свойствами ингибиторного рецептора.
CD307
FCRL5 (Fc Receptor-Like 5). Молекулярная масса 100 кДа. CD307 участвует в клеточной дифференцировке, иммунном ответе и, возможно, в развитии В-клеточных опухолей.
CD309
VEGFR2/KDR [Kinase insert Domain Receptor (a type III receptor tyrosine kinase)]. Рецептор – тирозинкиназа. Один из рецепторов для важного ангиогенного цитокина VEGF (сосудистый пермеабилизирующий фактор). Молекулярная масса 230 кДа. CD309 присутствует на плазматической мембране, эндосомах и околоядерной области клеток эндотелия и колокализуется с передающей сигнал ГТФазой, вовлекаемой в эндоцитоз рецептора. В ответ на связывание лиганда тирозинкиназный домен VEGFR2 проводит внутрь клетки сигналы, ответственные за митогенное действие, хемотаксис, клеточную проницаемость и выживаемость сосудистого эндотелия. Экспрессия CD309 играет важную роль в ангиогенезе, в том числе саркомы Капоши, связанной с синдромом приобретённого иммунодефицита.
CD312
EMR2 (Egf-like module containing, Mucin-like, hormone Receptor-like 2). Принадлежит к классу В семейства спаниновых трансмембранных рецепторов, 7-кратно пронизывающих клеточную мембрану (TM7). Молекулярная масса 90 кДа. Экспрессируется преимущественно миелоидными клетками, а также гладкомышечными клетками. CD312 опо-
средуют межклеточное прилипание через лиганд хондроитинсульфат из группы глюкозаминогликанов.
CD314
KLRK1 (Killer cell Lectin-like Receptor subfamily K, member 1). Молекулярная масса 42 кДа. В качестве активационного рецептора экспрессируется на всех NK-клетках, γδТ-клетках и на большинстве CD8+ Т-клеток. CD314 принадлежит к семейству молекул NKG2, экспрессируемых, главным образом, NK-клетками и представленных трансмембранными белками с характерным типом II мембранной ориентации (внеклеточный С-конец) и с зависимым от кальция С-типом лектиновым доменом. В ответ на инфицирование цитомегаловирусом человека фибробласты экспрессируют лиганды NKG2D и становятся чувствительными к лизису NK-клетками.
CD315
PTGFRN (Prostaglandin F2a Receptor Negative regulator). Молекулярная масса 135 кДа. Регуляторный белок рецептора простагландина F2α. Поверхностный белок суперсемейства иммуноглобулинов, включающий 6 внеклеточных иммуноглобулиновых доменов. С высокой специфичностью и стехиометричностью ассоциирует с CD81 или с CD81 и CD9 (комплекс CD81-CD9-FPRP), но не с интегринами или другими TM4SF-белками. PTGFRN взаимодействует с рецептором простагландина F2α и, возможно, с другими 7-кратно пронизывающими мембрану трансмембранными рецепторами, что приводит к снижению способности данных рецепторов связывать лиганд.
CD316
Предыдущее название CD81P3. IGSF8 (Immunoglobulin SuperFamily, member 8). PGRL (Prostaglandin regulatory-like) / (OMIM 606644; 1q23.1). Молекулярная масса 63 кДа. Принадлежит к суперсемейству иммуноглобулинов. Ассоциируется с тетраспанинами CD9, CD81 и CD82, образуя сеть молекулярных взаимодействий – тетраспаниновую паутину. (+) – на поверхности свежевыделенных гепатоцитов в связи с CD81, на большинстве В- и Т-лимфоцитов, NK-клеток. CD316 образует высокостехиометрический комплекс с CD82 и участвует в подавлении миграции раковых клеток, опосредованном через CD82.
CD317
BST2 (Bone marrow Stromal cell antigen 2). Костномозговые стромальные клетки вовлекаются в развитие и рост В-лимфоцитов. Играет роль в развитии пре-В-клеток и в патогенезе ревматоидного артрита.
CDCP1 (CUB Domain Containing Protein 1). Молекулярная масса 140 кДа. Под влиянием плазмина (сывороточная протеаза) и при адгезии происходит конверсия gp140 в р80. Фосфорилирование gp140 и р80 опосредуется через Src-семейство киназ на тирозиновых остатках, в частности, в эпидермальных ранах. Присутствует на поверхности метастазирующих клеток рака толстой кишки, лёгких, грудной железы, на лейкозных бластных клетках (преимущественно CD34+CD133+ миелолейкозных бластах), гемопоэтических стволовых клетках, негемопоэтических клетках с фенотипом стволовых и родоначальных (мезенхимальные стволовые клетки, нервные родоначальные клетки). Экспрессируется эпителиальными клетками нормальной толстой кишки.
CD319
SLAMF7 (SLAM Family member 7). Молекулярная масса 66 кДа. Участвует в регуляции адгезии лимфоцитов. Экспрессируется активированными NK-клетками, цитотоксическими лимфоцитами, активированными В-клетками, зрелыми ДК. CRACC является аутолигандом, и гомофильное взаимодействие CRACC регулирует цитолитическую активность NK-клеток.
CD320
8D6A. Белок массой 30 кДа, присутствующий на ФДК, блокада которого приводит к нарушению костимулирующей функции в отношении В-лимфоцитов.
CD321
F11R (F11 Receptor). Белок суперсемейства иммуноглобулинов. Молекулярная масса 32-35 кДа. Участвует в трансмиграции мононуклеарных клеток через стенки сосудов в очаги воспаления. Локализуется в области межклеточного контакта покоящихся эндотелиальных клеток. При обработке основным фактором роста фибробластов (bFGF) перемещается на клеточную поверхность.
CD322
JAM2 (Junctional Adhesion Molecule 2). JAM2 локализуется в области тесного контакта между клетками высокого эндотелия в лимфоидных органах, где лимфоциты постоянно покидают кровоток (трансмиграция). Присутствует также на эндотелии артериол и вокруг воспалительных и опухолевых очагов. Действует как адгезивный лиганд для взаимодействия между многими иммунными клетками и может играть роль в хоминге лимфоцитов во вторичные лимфоидные органы.
CDH1 (Cadherin 1). Молекулярная масса 120 кДа. CD324 классическая молекула из суперсемейства кадгеринов. Лиганд – CD103. Е-кадгерин играет роль в развитии опухолей и их метастазировании. Мутации CDH1 гена коррелируют с раком желудка, молочной железы, толстой кишки, щитовидной железы, яичников и др. Снижение экспрессии и функции CDH1 делает вклад в прогрессирование рака, усиливая пролиферацию, инвазию и/или метастазирование. Распределение Е-кадгерина в клетках эмбриона человека зависит от стадии развития. Белок Vpr ВИЧ-1 повышает экспрессию кадгерина на клетках-мишенях. Адгезивные механизмы, опосредованные через Е-кадгерин, участвуют во взаимодействии сперматозоида с оболочкой яйцеклетки.
CD325
CDH2 (Cadherin 2, type 1). Молекулярная масса 140 кДа. N-кадгерин – трансмембранный гликопротеин. CD325 участвует в процессе гаструляции и нужен для установления левоправой асимметрии. В центральной нервной системе участвует в адгезии синапсов, пре- и постсинапсов. N-кадгерин усиливает клеточную подвижность и инвазивность, играет ключевую роль в миграции клеток меланомы через эндотелий сосудов, вовлекается в прогрессирование первичного рака толстой кишки, участвует в контроле выживаемости поверхностных эпителиальных клеток яичников человека.
CD326
TACSTD1 (Tumor-Associated Calcium Signal Transducer 1). Трансмембранный гликопротеин. Молекулярная масса 30-40 кДа. Ассоциирован с доброкачественной и опухолевой пролиферацией. Экспрессируется на поверхности большинства нормальных клеток аденоматозного и простого эпителия, клетках желудочно-кишечных карцином и вовлекается в гомофильную адгезию на базолатеральной мембране. CD326 рассматривают как мишень для иммунотерапии карцином человека.
CD327
SIGLEC6 (Sialic acid binding Ig-like Lectin 6). Член суперсемейства иммуноглобулинов (подсемейство сиалоадгезинов). Участвует в межклеточной адгезии. Экспрессирован на наружной мембране клеток и способен связывать расположенные на клетках-партнёрах сиаловые кислоты, входящие в состав гликопротеинов и гликолипидов. Имеет цитоплазматический тирозиновый ингибиторный мотив ITIM (Immunoglobulin receptorfamily Tyrosine-basedInhibitory Motif). Высокий уровень экспрессии
CD327 выявляют в цито- и синцитиотрофобластах плаценты человека. Умеренная экспрессия белка характерна в селезёнке, лейкоцитах периферической крови (почти исключительно на В-клетках) и клетках тонкой кишки. Участвует в регуляции сывороточного уровня лептина.
CD328
SIGLEC7 (Sialic acid binding Ig-like Lectin 7). Молекулярная масса 75 кДа. SIGLEC7 и SIGLEC9 являются связанными с CD33-ингибирующими рецепторами NK-клеток. SIGLEC7 как ингибирующий рецептор, связывающий сиаловые кислоты, экспрессируется NK-клетками (преимущественно), субпопуляциями периферических Т-клеток (CD8+ Т-клетки), моноцитами (слабо).
CD329
SIGLEC9 (Sialic acid binding Ig-like Lectin 9) (см. CD328). Молекулярная масса 50 кДа. Молекула адгезии. Играет роль ингибирующего рецептора за счёт наличия цитоплазматического тирозинового ингибиторного мотива ITIM. Связывание сиаловых кислот приводит к подавлению активности естественных киллеров, снижению передачи сигнала с Т-клеточного рецептора, а в случае нейтрофилов, находящихся в очаге воспаления, – к индукции апоптоза. В макрофагах связывание SIGLEC9 усиливает образование ИЛ-10 и понижает ФНОа. SIGLEC9 экспрессирован в больших количествах на моноцитах и нейтрофилах и в меньшей степени на естественных киллерах, Т- и В-лимфоцитах. Провоспалительные цитокины повышают уровень CD329 на нормальных нейтрофилах. У больных острым септическим шоком или ревматоидным артритом на нейтрофилах экспрессия SIGLEC9 повышена.
CD331
FGFR1 (Fibroblast Growth Factor Receptor 1). Молекулярная масса 130 кДа. CD331 – член семейства FGFR. Рецептор для факторов роста фибробластов (FGF). FGFR1 экспрессируется ранними предшественниками гемопоэтических и эндотелиальных клеток, а также субпопуляциями клеток эндотелия в сосудах опухолей. CD331 критичен для гемопоэза, но не ангиогенеза. Приблизительно 5% CD34+ клеток, выделенных из костного мозга, пуповинной крови и мобилизованных в периферической крови, экспрессируют FGFR1. Мутация гена, кодирующего CD331, приводит к развитию синдрома Пфейффера (острое доброкачественное вирусное заболевание с поражением лимфоидной ткани, генерализованное или регионарное увеличение лимфатических узлов).
FGFR2 (Fibroblast Growth Factor Receptor 2) (см. CD331). Молекулярная масса 115-135 кДа. FGFR2 – высокоаффинный рецептор для кислого и основного фактора роста фибробластов (FGF) и фактора роста кератиноцитов (KGF). Амплификация гена, кодирующего FGFR2, ассоциирована со многими типами опухолей. FGFR2 играет важную роль в регуляции передачи сигналов в остеобластах, участвуя в нормальной оссификации черепа у человека. Активация FGFR2 снижает присоединение остеобластов к фибронектину, приводит к индукции апоптоза остеобластов. Мутации гена СD332 ассоциированы со многими синдромами преждевременного заращения швов черепа и костной мальформации.
CD333
FGFR3 (Fibroblast Growth Factor Receptor 3) (см. CD331). Молекулярная масса 115-135 кДа. Член семейства FGFR. Связывает кислый и основной фактор роста фибробластов, участвует в развитии и сохранении костной ткани. Мутации гена CD333 приводят к преждевременному сращению швов черепа, разнообразным типам костной дисплазии (ахондроплазии и танатофорической дисплазии). Мутация гена, кодирующего FGFR3, влияет на развитие, но не на прогрессирование рака мочевого пузыря. Повышенная экспрессия FGFR3 может играть важную канцерогенную роль в печени.
CD334
FGFR4 (см. CD331). Молекулярная масса 110 кДа. Взаимодействует преимущественно с кислым фактором роста фибробластов (FGF). Повышена экспрессия на опухолях женской половой сферы. Участвует в развитии рака молочной железы и яичников. Аллель Arg388 гена, кодирующего FGFR4, ассоциирован с повышением частоты и клинической агрессивности рака простаты.
CD335
NCR1 (Natural Cytotoxicity triggering Receptor 1). Молекулярная масса 46 кДа. Член семейства рецепторов естественной цитотоксичности (NCR). Экспрессируются почти исключительно NK-клетками и выполняют функцию главных активирующих рецепторов. Плотность NCR на NK-клетках коррелирует с цитолитической активностью против опухолевых клеток. Связывание NCR с предполагаемым лигандом опухолевых клеток может запускать апоптоз NK-лимфоцитов. NKp46рецепторы участвуют в клеточно-опосредованном лизисе клеток, инфи-
цированных внутриклеточными патогенами. Ослабление этой функции ассоциируется с тяжёлыми проявлениями инфекционных заболеваний.
CD336
NCR2 (Natural Cytotoxicity triggering Receptor 2) (см. CD335). Молекулярная масса 44 кДа. Член семейства рецепторов естественной цитотоксичности (NCR), важных для распознавания опухолевых клеток-мишеней. Экспрессируется только на активированных NK-клетках человека. CD336 существенен не только для противоопухолевой защиты, но и участвует в «самоубийстве» NK-клеток.
CD337
NCR3 (Natural Cytotoxicity triggering Receptor 3) (см. CD335). Молекулярная масса 30 кДа. Экспрессируется на субпопуляции NK-клеток периферической крови человека и вовлекается в киллинг опухолевых клеток NK-лимфоцитами. Участвует в запуске активации NK-клеток при взаимодействии со стромальными клетками костного мозга in vitro. Опосредованная через NK-клетки индукция созревания ДК зависит от CD337. Уровень CD337 в крови и синовиальной жидкости возрастает у больных ревматоидным артритом и коррелирует с тяжестью воспалительного процесса в синовии.
CD338
ABCG2 [ATP-Binding Cassette, sub-family G (WHITE), member 2]. Мембранный белок суперсемейства транспортёров АТФ-связывающих кассет (АВС – ATP-binding cassette). Молекулярная масса 72 кДа. CD338 экспрессируется в большом количестве на синцитиотрофобластах плаценты, на апикальной мембране эпителия тонкой кишки, на мембране канальцев печени и на клетках эндотелия микрососудов мозга человека. CD338 экспрессируется и функционирует как транспортёр в мозге; выявлен на многих стволовых клетках и может защищать их от экзогенных и эндогенных токсинов; защищает развивающийся плод от воздействия потенциально токсичных ксенобиотиков. Повышенная экспрессия CD338 ассоциируется с высокими уровнями устойчивости ко многим противораковым агентам, включая антрациклины, митоксантрон и камптотехины, повышая выведение лекарственных средств. Взаимодействует с гемом и другими порфиринами, защищает клетки и/или ткани от накопления протопорфирина при гипоксии.
CD339
JAG1 [ Jagged 1 (Alagille syndrome)]. «Зазубренный» белок типа 1 (JAG1). Аналог соответствующего белка дрозофил. Трансмембранный белковый
лиганд для эволюционно консервативного Notch1 рецептора. Молекулярная масса 150 кДа. JAG1 играет важную роль в гемопоэзе. Микроделеция гена JAG1 (20p12) приводит к развитию синдрома Алажиля (артериопечёночная дисплазия, синдром Алажиля-Ватсона) – генетического заболевания, наследуемого по аутосомно-доминантному типу. • Семейство Notch гетеродимерных трансмембранных белков играет интегральную роль в судьбе клеток, положительно или отрицательно влияя на пролиферацию, дифференцировку и апоптоз. У человека выявлены 4 Notch-рецептора – Notch1, Notch2, Notch3 и Notch4. Notch1 состоит из внеклеточного домена с 36 повторами, подобными эпидермальному фактору роста, одного трансмембранного домена и внутриклеточного домена, состоящего из молекулы, ассоциированной с RBP-JK, акрилиновых доменов и региона, обогащенного последовательностью пролин-глютаматсерин-треонин. Известно несколько лигандов Notch-рецепторов: Delta-1, Delta-2, Delta-3, Delta-4, гомологичные Delta дрозофил, и Jagged-1, Jagged-2, гомологичные Serrate дрозофил. При связывании лигандами Notch-рецепторы протеолитически расщепляются, при этом освобождается внутриклеточный домен Notch (NICD), который перемещается в ядро и активирует гены-мишени. Notchрецепторы, экспрессируемые на гемопоэтических стволовых клетках, взаимодействуют с лигандами на костномозговых стромальных клетках и контролируют развитие и дифференцировку Т-лимфоцитов. Дефицит и мутации Notch-рецепторов и лигандов приводят к тяжёлым дефектам внутриутробного развития мышей. Notch-рецепторы и их лиганд JAG1 с высокой частотой присутствуют на культивируемых и первичных клетках множественной миеломы и глиомы человека. Мутация гена Jag1 приводит к развитию аутосомнодоминантного синдрома Алажиля, характеризующегося пятью главными симптомами: холестазом, деформацией позвоночника, дефектами сердца, глаз и лица, а также хронической почечной недостаточностью и гипертензией.
CD340
ERBB2 (v-erb-b2 erythroblastic leukemia viral oncogene homolog 22). Член тирозинкиназного семейства рецепторов типа III. Повышенную экспрессию CD340 выявляют при многих формах рака, включая рак молочной железы и яичника. Она коррелирует с плохим прогнозом. CD340 рассматривают как биомаркёр и мишень для иммунотерапии рака.
FZD4 [Frizzled homolog 4 (Drosophila)]. Аналог соответствующего белка дрозофилы (D. melanogaster). Относится к семейству (FZD1-10) белка «завивки» (frizzled). Большинство рецепторов frizzled соединены с β-катениновым сигнальным путём. FZD4 играет важную роль в ангиогенезе сетчатки. Мутации в N- или C-концевых регионах FZD4 ассоциируются с семейной аутосомно-доминантной экссудативной витреоретинопатией.
CD349
FZD9 [Frizzled homolog 9 (Drosophila)]. Экспрессируется в мозге, в частности в гиппокампе. CD349 также выявлен в клетках рака желудка. В астроцитомах человека FZD9 присутствует в микрососудах и опухолевых клетках. FZD9 – один из маркёров мезенхимальных стволовых клеток, происходящих из костного мозга.
CD350
FZD10 (см. CD344). Большое количество мРНК FZD10 обнаружено в плаценте и тканях эмбриона: почках, лёгких и мозге. В мозге взрослых в большом количестве представлен в мозжечке. Обильно экспрессируется в культивируемых опухолевых клетках (рака шейки матки, толстой кишки и др.). FZD10 имеет 65,7% аминокислотную гомологию с FZD9. Усиление регуляции мРНК FZD10 в некоторых типах клеток человека может привести к канцерогенезу через активацию p-катенинового сигнального пути.
CD351
FCAMR, высокоаффинный Fc-рецептор к IgA, IgM. (+) – Т-и В-клетки, макрофаги/моноциты.
CD352
SLAMF6, Ly108, NTB-A. Трансмембранный белок суперсемейства иммуноглобулинов, принадлежащий к подсемейству CD2. Участвует в активации NK-клеток. (+) – дендритные, Т-, В-, NK-клетки, макрофаги/моноциты, гранулоциты.
CD353
SLAMF8, BLAME. Присутствует на В-клетках и на макрофагах/моноцитах. Играет роль в дифференцировке В-лимфоцитов и модуляции сигнала с BCR.
TREM1. Поверхностный рецептор, активация которого вызывает выброс клетками провоспалительных хемокинов и цитокинов. (+) – дендритные, Т-, В-, NK-клетки, макрофаги/моноциты, гранулоциты.
CD355
CRTAM, цитотоксическая и регуляторная молекула Т-клетки. Взаимодействие с CADM1 приводит к усилению цитотоксичности и увеличению секреции ИФНγ (+) -Т-, В-, NK-клетки.
CD357
TNFRSF18, 18-й член суперсемейства рецепторов ФНО, GITR. Вовлечен во взаимодействия между активированными Т-лимфоцитами и эндотелиальными клетками. Участвует в активации NF-kB. (+) – дендритные, Т-, В-, NK-клетки, макрофаги/моноциты.
CD358
TNFRSF21, 21-й член суперсемейства рецепторов ФНО, рецептор DR6 (от Death Receptor). Лигандом служит N-APP. Участвует в активации NF-kB и индукции апоптоза. (+) – Т-, В-клетки, макрофаги/моноциты.
CD359
PI16. Ингибитор сериновых протеаз. Присутствует на Т-клетках.
CD360
IL21R. Гетеромеризуется с общей y-субъединицей рецепторов интерлейкинов (CD132), (+) – дендритные, Т-, В-, NK-клетки, макрофаги/ моноциты, гранулоциты.
CD361
EVI2B – сайт эктопической вирусной интеграции 2B. (+) – Т-, В-клетки, макрофаги/моноциты, гранулоциты.
CD362
Syndecan-2. Поверхностный протеогликан, содержащий гепарансульфат. Играет роль в регуляции пролиферации и адгезии. (+) – Т-, В-клетки, макрофаги/моноциты, гранулоциты, кератиноциты.
CD363
S1PR1, сфингозин-1-фосфатный рецептор 1. Рецепторы этого семейства передают сигнал внутрь клетки через G-белки. Активация этого рецептора вызывает адгезию клеток. (+) – Т-, В-, NK-клетки, эндотелий.

